黄体酮
一、黄体酮的基本性状
本品为孕甾-4-烯-3,20-二酮,孕激素类药。根据药典要求,按干燥品计算,含C21H30O2应为98.0%~103.0%。
黄体酮为白色或类白色的结晶性粉末;无臭,无味。在三氯甲烷中极易溶解,在乙醇、乙醚或植物油中溶解,在水中不溶。熔点(2010年版药典二部附录ⅥC)为128~131℃。加乙醇溶解并定量稀释制成每1ml中约含10mg的溶液,在25℃时,依法测定(2010年版药典二部附录Ⅵ E),比旋度为+186°至+198°。
1.1 鉴别
- 取本品约5mg,加甲醇0.2ml溶解后,加亚硝基铁氰化钠的细粉约3mg、碳酸钠与醋酸铵各约50mg,摇匀,放置10~30分钟,应显蓝紫色。
- 取本品约0.5mg,加异烟肼约1mg与甲醇1ml溶解后,加稀盐酸1滴,即显黄色。
- 在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
- 本品的红外光吸收图谱应与对照的图谱(《药品红外光谱集》434图)一致。
1.2 检查
1.2.1 有关物质
取本品,加甲醇溶解并稀释制成每1ml中约含1mg的溶液,作为供试品溶液;精密量取1ml,置100ml量瓶中,用甲醇稀释至刻度,摇匀,作为对照溶液。照含量测定项下的色谱条件,取对照溶液10μl注入液相色谱仪,调节检测灵敏度,使主成分色谱峰的峰高约为满量程的30%。再精密量取供试品溶液与对照品溶液各10μl,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的2倍,供试品溶液色谱图中如有杂质峰,单个杂质峰面积不得大于对照溶液主峰面积的0.5倍(0.5%),各杂质峰面积的和不得大于对照溶液主峰面积(1.0%)。供试品溶液色谱图中任何小于对照溶液主峰面积0.05倍的色谱峰可忽略不计。
1.2.2 干燥失重
取本品,在105℃干燥至恒重,减失重量不得过0.5%(2010年版药典二部附录ⅧL)。
1.3 含量测定
照高效液相色谱法(2010年版药典二部附录ⅤD)测定。
1.3.1 色谱条件与系统适用性试验
用辛烷基硅烷键合硅胶为填充剂;以甲醇-乙腈-水(25;35:40)为流动相;检测波长为241nm。取本品25mg,置25ml量瓶中,加0.1mol/L氢氧化钠甲醇溶液10ml使溶解,置60℃水浴中保温4小时,放冷,用1mol/L盐酸溶液调节至中性,用甲醇稀释至刻度,摇匀,取10μl注入液相色谱仪,调节流速使黄体酮峰的保留时间约为12分钟,调节检测灵敏度,使主成分色谱峰的峰高达到满量程,色谱图中黄体酮峰与相对保留时间约为1.1的降解产物峰的分离度应大于4.0。
1.3.2 测定法
取本品,精密称定,加甲醇溶解并定量稀释制成每1ml中约含0.2mg的溶液,精密量取10μl注入液相色谱仪,记录色谱图;另取黄体酮对照品,同法测定。按外标法以峰面积计算,即得。
1.4 制剂
黄体酮注射液 、黄体酮软胶囊
二、黄体酮的临床应用
黄体酮主要功效就是补充孕激素,临床常用于治疗习惯性流产、先兆性流产、无排卵型功血或闭经,以及联合雌激素治疗更年期综合征。
2.1 保胎应用
天然的黄体酮是可以用来保胎的,只要孕酮激素低于正常值,并且严格遵照医生的指示用药,那么胎儿是不会有问题的。天然黄体酮通常只会在两种情况下出现问题,一:孕酮激素的水平正常,却还服用黄体酮。二:没有听从医生的嘱咐,过量或频繁服用黄体酮。当出现以上两种情况的时候,就会导致男胎女性化,女胎雌性激素过高,更加女性化。
如果是人工合成的黄体酮,副作用就会较大,有可能会导致胚胎发育异常,特别是男胎女性化,又因为人工合成的黄体酮含有炔诺酮(具有雄性化的作用),也有几率使女胎男性化。
临床常用天然孕激素:黄体酮注射剂、琪宁黄体酮软胶囊等。
2.2 输尿管结石
黄体酮能使泌尿系统平滑肌普遍松弛、扩张,内径扩大,并通过对抗醛固酮,具有促进钠、氯的排泄和利尿作用,因此用于治疗输尿管结石。方法是肌肉注射黄体酮20毫克,每日2次,连续14天为1疗程。患者为利于结石排出,要多喝水,多运动。如输尿管结石在0.6-1厘米以内,用此法排石效果较好,排石成功率极高。
2.3 肾绞痛
肌注黄体酮能松弛输尿管平滑肌,减慢蠕动频率及交感神经传入纤维的痛觉冲动,并使结石排出,对各种肾绞痛有良好而持久的镇痛作用。有人推荐黄体酮为治疗肾绞痛的首选药物,特点是止痛迅速。
2.4 慢性呼吸衰竭
肌注黄体酮10-20毫克,每日1次或每周2-3次,可明显改善慢性呼吸衰竭病人的症状。这是因为黄体酮具有呼吸兴奋作用,能改善二氧化碳刺激所致的换气反应低下,故可用于慢性呼吸衰竭。
2.5 男性周期性精神病
目前认为本病与间脑—垂体—植物神经—性腺功能失调有关,黄体酮抑制垂体分泌,促进激素,维持内分泌平衡,适用于多种药物治疗无效的男性周期性精神病。在出现症状前10天肌注黄体酮20毫克,连用5天,同时每日并用氯丙嗪100毫克。症状未再出现后,每隔25天即症状出现前10天重复上述治疗,持续半年。
2.6 肝硬化腹水
黄体酮为一甾体激素,通过抗醛固酮而产生利尿作用,使肝硬化病人尿量增加,腹水减少。肌注黄体酮40-60毫克,1日1次,连续使用1-2周。
2.7 胆囊炎
肌注黄体酮20毫克,1日2次,同时配用抗生素、激素等,6天为1疗程,有效率为94%。
2.8 糖尿病
黄体酮通过抑制生长激素的分泌使血糖下降。血糖大于170毫克的成年糖尿病患者,肌注黄体酮或口服黄体酮4毫克,1日3次,使血糖得到很好的控制。
2.9 睡眠呼吸暂停综合征
本病患者伴随着呼吸暂停而发生血氧饱和度明显下降,黄体酮能加强呼吸,改善肺泡功能,使二氧化碳换气反应及负荷代偿反应增加。用法是肌注黄体酮20-40毫克,每日1次。
2.10 经期哮喘
有哮喘病的妇女30%以上出现在经前期恶化,最大呼吸量多有中度下降。经常规治疗无效的严重经前期哮喘患者,肌注黄体酮100毫克,每日1次。
三、孕期黄体酮不足
3.1 先治疗再怀孕
若在孕前发现孕酮含量不达标的话,可以先进行治疗然后再怀孕。对女性而言,孕酮是维持正常月经规律的必要物质,如果在备孕前发现孕酮含量较低,则最好到医院进行详细检查,并配合医生的指导、积极治疗。
3.2 通过食疗调节
孕妇若孕酮含量较低则可以通过日常饮食进行补充,摄取大豆异黄酮以及维生素E等来帮助提高孕酮的含量,像猕猴桃、草莓等都是较好的食物。
3.3 药物补充孕酮
若女性孕酮含量较低,也可以直接通过药物来补充,服药或注射皆可。若通过打针来补充孕酮,大概10天左右就能达到正常含量,若吃药,需要根据孕妇个人的身体状况决定吃药剂量和时间。在此期间孕妇应该及时到医院诊治,并且配合医生调节身体。
3.4 必要时放弃保胎
若女性已经出现孕酮含量低于15ng/ml的现象,而且经过检查发现没有胎心的话,那么基本上要放弃保胎了。这种情况大都是因为胎儿发育不正常所致,因此若继续保胎仍然可能出现流产、胎儿畸形等情况。
3.5 其他措施
孕妇孕酮低,应该注意日常作息和饮食,保证足够的睡眠,多静养,合理搭配膳食,多多补充营养。
四、黄体酮在临床研究进展
黄体酮(Progesterone, 又称孕酮) 是目前黄体支持的首选药物。内源性黄体酮可使子宫内膜从增生期转化为分泌期, 从而促使子宫内膜成熟、剥脱并维持月经周期。同时黄体酮可使子宫做好接受胚胎植入的准备, 在妊娠早期起到稳定子宫内膜和保胎作用, 因此是妊娠成功所必需的物质。根据结构通常分为黄体酮及其衍生物。黄体酮衍生物又分为:17α-羟孕酮类(代表药物为醋酸甲羟孕酮、己酸羟孕酮) 和19-去甲睾丸酮类(代表药物为炔诺酮、烯诺孕酮等) 。
黄体酮是由卵巢分泌的一种天然孕激素, 是目前临床黄体支持的首选药物, 对女性子宫内膜有显著的保护作用。临床常用的适应症有:预防早产、功能失调性子宫出血、胚胎移植后的辅助生殖、黄体功能不全等。黄体酮无雄激素活性, 副作用小, 临床安全性主要由给药途径决定。黄体酮口服给药、阴道给药安全性高于肌内注射, 肌内注射不良反应发生率与给药剂量有直接关系。
目前临床上可用于黄体支持的黄体酮主要有口服、注射、阴道给药等三种给药方式。口服制剂存在肝脏首过效应, 肝脏清除90%以上孕酮, 血浆内仅存下不到10%的有效成分, 血药浓度低下, 加大给药剂量会导致患者产生明显的嗜睡、恶心、面色潮红等症状。肌内注射黄体酮(Intramuscular Injection of Progesterone, IMP) 是最普遍的黄体支持形式, 临床疗效确切, 但IMP需长期给药, 易造成注射部位红肿、皮下组织萎缩。黄体酮阴道给药主要是利用子宫内膜“局部高浓度效应”, 黄体酮在子宫局部达到有效浓度发挥作用。研究显示, 阴道栓剂和阴道缓释凝胶通常安全且耐受性良好。
4.1 临床药理学
4.1.1 药效学
黄体酮由孕二醇在黄体生成激素作用下转化而成, 为临床常用的孕激素类药物, 已被广泛应用于各种妇科疾病。黄体酮通过结合到特异性受体作用于子宫、卵巢以及乳房和中枢神经系统。其受体(Progesterone receptor, PR) 在体内分布较广, 并存在两种不同亚型:PR-A和PR-B。两种亚型具有相同的基因编码, 且序列是一致的, 差异在于PR-A的N-末端比PR-B少164个氨基酸。
黄体酮通过降低子宫内膜细胞的有丝分裂活动, 使子宫内膜的分泌发生变化, 有利于受精卵的着床。研究显示:使用黄体酮200 mg·d-1~300 mg·d-1, 不同时间段取得的活检样本检查结果表明, 子宫内膜细胞有丝分裂活性逐渐降低。黄体酮是醛固酮的竞争性抑制剂, 口服黄体酮对钠代谢的主要作用为尿钠排泄显著增加, 与使用低剂量螺内酯等抗醛固酮药物观察到的临床症状相似。采用随机对照双盲实验研究黄体酮对患者血压的作用, 结果表明, 口服微粉化黄体酮可使高血压患者血压下降、增强降压药的降压作用。黄体酮通过减少神经损伤模型中的自由基、炎性细胞因子, 诱导细胞凋亡, 可以有效地减轻神经损伤。
4.1.2 药代动力学
黄体酮体内药代动力学主要受给药剂型影响;黄体酮口服后主要经胃肠道吸收, 且吸收迅速, 达峰时间(Tmax) 2~4 h, 达峰浓度(Cmax) 8.5~70.6 ng·m L-1。食物可促进黄体酮在体内的吸收, 提高生物利用度。黄体酮口服吸收进入血液后主要与血清白蛋白(50%~54%) 和皮质类固醇结合球蛋白(43%~48%) 结合;黄体酮口服吸收后主要通过肝脏代谢, 代谢物孕二醇和孕烯醇酮在肝脏中转化为葡萄糖苷酸和硫酸盐代谢物。葡萄糖苷酸和硫酸盐代谢物主要通过肾脏消除, 经胆汁排泄的黄体酮代谢物可能会发生肠肝循环。因此口服制剂生物利用度较低, 临床主要适用黄体功能不足、症状较轻患者。肌内注射黄体酮注射液10 mg、25 mg和50 mg的Cmax平均值分别为7 ng·mL-1、28 ng·mL-1和50 ng·mL-1。肌内注射IMP起效快, 可用于口服、阴道给药吸收差的患者。黄体酮阴道缓释凝胶吸收半衰期约为25~50 h, 消除半衰期为5~20 min, Cmax为7~20 ng·m L-1。给药持续时间久, 不同患者吸收相对差异小, 副作用小, 临床适用范围广, 但价格较高。
4.2 临床应用
4.2.1 先兆流产
先兆流产(Threatened Abortion) 是指妊娠28周前, 孕妇出现阴道少量流血, 无妊娠物排出, 随后出现阵发性下腹痛或腰背痛, 妇科检查宫颈口未开, 胎膜未破, 子宫大小与停经周数相符。在此类孕妇中, 黄体功能不足者高达23%~67%, 黄体酮可以诱导子宫颈分泌物中细胞因子的浓度发生变化, 因此是临床上治疗先兆流产的主要药物。研究表明, 在先兆流产的妇女中使用黄体酮治疗可增加胎儿的生存率。Beigi A等对190名患有先兆流产的妇女采用随机双盲、单中心对照临床试验, 研究了黄体酮对孕妇早孕发病时间的影响。结果证实, 黄体酮能显著降低孕妇先兆流产风险, 且黄体酮阴道给药组和注射给药组预防早产儿风险相同。Duan LJ等将21 853名孕妇分为两组:用于对比黄体酮对早产、妊娠并发症的影响。研究表明:孕妇流产率随其年龄和流产次数增加而增加, 并且黄体酮可提高先兆流产孕妇的胎儿存活率;妊娠并发症与低体重新生儿的风险并无关联。
Palagiano A等对50名黄体功能不足和先兆流产的妇女进行了一项随机双盲试验。证实了黄体酮阴道缓释凝胶(Crinone 8%) 在缓解疼痛和降低子宫收缩频率方面的作用(P<0.005) 。两组患者妊娠率和自然流产率结果显示, 黄体酮阴道缓释凝胶有助于改善妇女妊娠并发先兆流产和黄体功能不足。Дубоссарская通过对4150名妇女进行随机双盲、多中心安慰剂对照试验, 进一步证实黄体酮可降低先兆流产妇女的流产率, 同时不增加胎儿先天性异常的发生率。
4.2.2 预防早产
早产(PTB) 是怀孕期间最常见的并发症之一, 可导致新生儿死亡和多种疾病, 包括长期后遗症、脑瘫和发育障碍。PTB最有效的治疗方法是预测和预防风险。黄体酮补充疗法是少数被证实有效的方法之一, 目前用于预防PTB的孕激素治疗有两种方案:每周肌内注射17-α己酸羟孕酮(17α-OHPC) 或每日使用黄体酮阴道缓释凝胶、阴道栓剂或口服胶囊。不同黄体酮剂型对PTB的影响见表1。
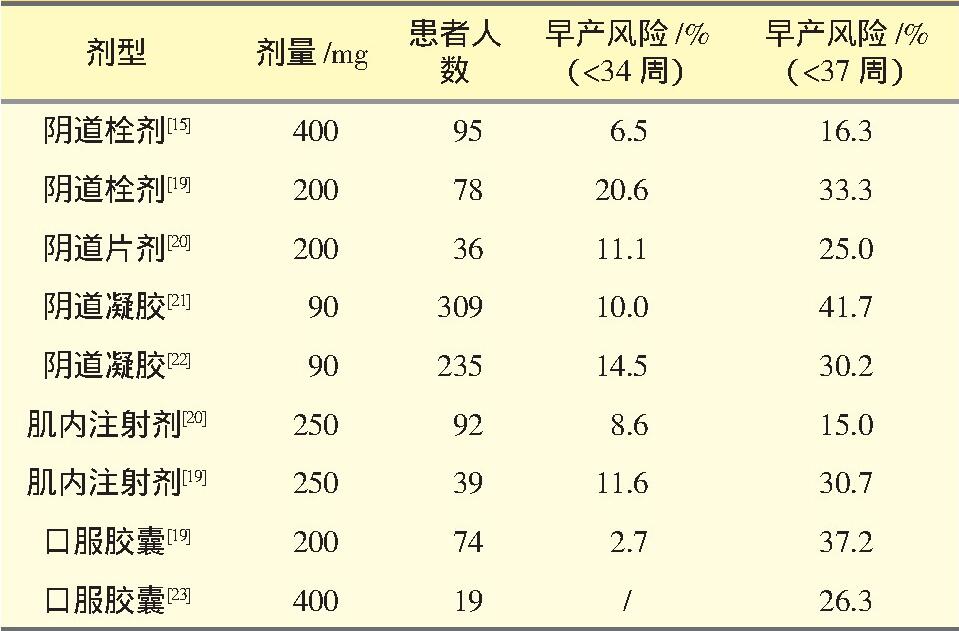
对于有自发性PTB病史(包括早产和胎膜早破) 的单胎孕妇, 每周注射17α-OHPC 250 mg或每日给予黄体酮阴道栓剂(100 mg或200 mg) 可有效预防复发PTB。在双胎妊娠妇女中, 注射17α-OHPC或使用黄体酮阴道栓剂、凝胶剂均可预防PTB。
4.2.3 辅助生殖
在辅助生殖技术(Assisted reproductive technique, ART) 治疗中, 超促排卵可以明显地改善多个卵泡发育的同步性会, 导致多个黄体同时发育, 合成并分泌超生理量的雌、孕激素, 并负反馈抑制下丘脑-垂体轴, 抑制LH分泌, 从而引起黄体功能不全, 其发生率几乎是100%, 影响了胚胎种植, 这会直接导致ART的失败。所以, 黄体支持是目前体外受精-胚胎移植(IVF-ET) 中的常规程序, 其虽然不能改变子宫内膜种植窗的提前及内膜的提前成熟, 但是它可以改善黄体功能。
IVF后给予黄体酮阴道缓释凝胶是提供黄体支持的一种安全、可接受的方法。Tsai YC等比较了IVF后的胚胎移植(IVF-ET) 中黄体酮阴道给药与肌内加口服给药黄体支持的临床效果。将114名IVF-ET患者根据黄体支持药物的差异分为两组:第1组26名患者接受Crinone 8%, 第2组88名患者接受肌内注射加口服黄体酮。两组临床疗效结果显示:两组临床妊娠率差异无统计学意义(第1组53.8%, 第2组48.9%) 。第1组的胚胎植入率为34.8%(24/69) , 而第2组的胚胎植入率为24.9%(P>0.05) 。
Abuzeid O等比较了IVF-ET患者使用黄体酮阴道缓释凝胶与黄体酮注射液的黄体支持效果。162例患者(<35岁) 随机分成黄体酮阴道给药组与肌肉给药组。与黄体酮肌肉给药组(4.8~1.8 mIU·mL-1) 相比, 黄体酮阴道给药组(5.9~1.8 mIU·mL-1) 的基线卵泡刺激素水平较高(P<0.001) 。临床妊娠率分别为62.4%和63.5%, 分娩率分别为51.5%和57.1%。表明35岁以下IVF-ET妇女中黄体酮阴道给药和肌内注射给药疗效相当。
目前黄体支持常用的黄体酮有三种给药途径:口服、肌内注射及阴道给药, 分别是黄体酮胶囊、黄体酮注射液及黄体酮阴道缓释凝胶, 三种给药方式各有其优缺点。黄体酮胶囊口服方便, 患者依从性好, 但生物利用度相对较低;黄体酮注射液价钱低廉, 应用时间长, 有效性及安全性肯定, 但患者需要往返医院使用不方便, 患者依从性差, 且还有注射部位疼痛和出现硬结的缺点;黄体酮阴道缓释凝胶阴道给药, 副作用小, 便于操作, 患者依从性好, 但价格高, 阻碍了广泛应用, 国内多个大中心研究得出黄体酮阴道缓释凝胶在辅助生殖技术中作为黄体支持具有满意的疗效和安全性。
4.2.4 经前期紧张综合征
经前期紧张综合征(Premenstrual Syndrome, PMS) 是指妇女在月经周期的后期(黄体期D14-D28) 表现出一种衰弱状态的症状。PMS由月经周期后期卵巢分泌的黄体酮减少所引起, 黄体酮水平降低导致黄体酮的分解产物四氢孕酮的量减少, 四氢孕酮具有镇静止痛的作用。补充黄体酮可以有效改善PMS症状。
Redei E等研究显示, 由于PMS发生在排卵周期中, 黄体功能不足可能是易感女性症状的根本原因或触发症状。Baker ER等进一步研究黄体酮治疗PMS的疗效。采用随机双盲、对照试验, 对17例中度至重度PMS患者使用黄体酮阴道栓剂200 mg, 持续7个月。在紧张症状的亚类中, 发现对紧张、情绪波动、烦躁、焦虑等症状有显著改善。结果显示, 黄体酮的代谢物四氢孕酮可能作为抗焦虑剂发挥作用, 改善焦虑和情绪波动。目前的研究证实了每日两次黄体酮阴道栓剂200 mg临床治疗的有效性, 可减轻与焦虑和烦躁等相关的一些PMS症状。但在PMS群体中哪些患者最有可能从这种治疗中获益则需要进一步评估。
4.2.5 功能失调性子宫出血与闭经
功能失调性子宫出血(Dysfunctional Uterine Bleeding, DUB) 是指异常的子宫出血, 经诊查后未发现有全身及生殖器官器质性病变, 而是由于神经内分泌系统功能失调所致。孕激素或雌激素和孕激素与雌激素联合应用已广泛应用于DUB引起的不规则或过度出血, 但不同剂型孕激素的临床治疗效果相差甚远。
Kostova P等研究37名绝经前妇女给予阴道黄体酮治疗DUB的临床疗效。研究结果表明, 根据强度(P=0.0068) 、出血持续时间(P=0.00) 、子宫内膜厚度减少(P=0.0068) , 差异无统计学意义, 黄体酮治疗DUB有效。在临床研究的基础上, 结果证实了黄体酮的预防作用, 可以作为绝经前妇女DUB的有效而安全的治疗方案。
Savas K等比较了阴道黄体酮与口服地屈孕酮的临床疗效。将69例DUB妇女随机分成口服地屈孕酮组(n=35) 和阴道黄体酮组(n=34) 。口服地屈孕酮组和阴道黄体酮组第一个月末分别有81%和93%的患者形成规律的出血模式。两组之间月经记录和子宫内膜组织学结果差异无统计学意义, 阴道黄体酮可以替代口服制剂治疗DUB。
闭经也是一种临床较为多见的妇科病, 病因与功能失调性子宫出血相同, 最常见的临床表现为月经不通, 伴有腹胀腹痛、乳房胀痛等症状。在治疗无排卵型DUB及闭经时, 在戊酸雌二醇基础上给予黄体酮胶囊可以降低子宫内膜厚度, 缩短月经周期。
Warren MP等采用多中心随机开放实验, 评估黄体酮阴道缓释凝胶(Crinone 4%和8%) 治疗127名继发性闭经妇女的安全性和有效性。雌激素化患者每两日使用一次Crinone(4%或8%) , 每月6次。结果显示, 在两组中分别有92%(Crinone 4%) 和100%(Crinone 8%) 患者的黄体功能发生改变, 有81%(Crinone 4%) 和82%(Crinone 8%) 患者出现撤药性出血。无患者出现与治疗有关的严重副作用。与雌激素单独治疗相比, 加用黄体酮治疗可使副作用(包括心理症状) 的发生率降低。两种剂量的顺应性均超过98%。因此, Crinone是继发性闭经女性激素替代疗法的一种新颖、有效且耐受性良好的选择。
4.2.6 与雌激素联合使用治疗围绝经期综合症
围绝经期是指妇女绝经前后的一段时期, 一般从45岁左右开始至停经后12个月内的时期。围绝经期妇女的卵巢功能下降, 常常会带来生殖激素波动性变化, 各种绝经综合征症状逐渐出现, 不利于女性的身体健康。国际绝经协会(International menopause society, IMS) 推荐绝经期激素治疗(Menopause hormone therapy, MHT) 作为维护围绝经期和绝经后妇女健康总策略的一部分, 有完整子宫的绝经妇女在应用雌激素同时应加用适量的孕激素可以有效缓解绝经相关症状, 保护子宫内膜, 尤其在绝经早期开始使用, 还可以形成对骨骼、心血管和神经系统的长期保护。
有学者实验治疗1组给予口眼戊酸雌二醇片1日1mg加黄体酮胶囊50mg, 治疗两组口服戊酸雌二醇片1日1mg加黄体酮胶囊1日100mg, 治疗3组给予戊酸雌二醇片1mg加醋酸甲羟孕酮片1日4mg, 共治疗12个周期。最终研究结论指出三种治疗方案均能改善绝经妇女症状及子宫内膜厚度, 但戊酸雌二醇片1日1mg加黄体酮胶囊1日50mg的不良反应最低, 是最佳的治疗方案。激素替代治疗可明显增加MPS患者子宫内膜厚度, 改善体内激素水平, 缓解围绝经期症状和不良情绪。
4.2.7 其他
黄体功能不足(luteal phase defects, LPD) 是指卵巢排卵后形成的黄体内分泌功能不足, 使子宫内膜分泌转化不足, 出现排卵性出血, 且不利于受精卵的着床, 可导致不孕或习惯性流产。黄体酮阴道栓是LPD临床常用的治疗药物。
黄体酮不仅是由卵巢、肾上腺皮质激素、胎盘产生的常见类固醇激素, 还是一种在大脑和脊髓自身合成、有自身受体的神经活性甾体。最新研究显示, 黄体酮在妊娠时可保护胎儿中枢神经免受损害, 促进中枢神经系统的增殖和发育。Herzog AG等评估了黄体酮治疗294例癫痫复杂性发作患者的临床疗效和安全性, 结果表明, 黄体酮治疗癫痫复杂性患者无效, 但能够显著改善患者癫痫的发作频率。
4.3 临床安全性
黄体酮不同给药途径对临床安全性影响较大。黄体酮肌内注射用于黄体支持较易形成局部硬结, 产生疼痛且影响药物的吸收, 降低了患者的耐受性, 甚至可导致炎症, 严重者可引发无菌性脓肿, 研究显示, 黄体酮肌内注射不良反应的发生率与患者用药剂量有直接关系:每次注射20 mg, 不良反应发生率为34.7%;每次注射10 mg, 不良反应发生率为3.8%。
Soderpalm AHV等比较了IMP在女性和男性中的镇静作用。每月肌内注射黄体酮200 mg。给药后约3小时达到Cmax, 男性平均Cmax为194 ng·mL-1, 女性Cmax为270 ng·mL-1, 血浆孕酮水平无显著的性别差异。在17名受试者中, 有6名报告注射部位轻度至中度疼痛;2名受试者注射黄体酮后体温升高;此外, 一些受试者报告疲劳增加。Meis PJ等报道231例患者肌内注射黄体酮的不良事件, 其中有:注射部位疼痛(34.2%) 、肿胀(14.1%) 、瘙痒(11.3%) 、瘀伤(6.7%) 。研究报道肌内注射黄体酮注射液的孕妇胎儿死亡率和流产率显著升高。
黄体酮阴道给药安全性高, 临床不良反应少。据报道黄体酮阴道给药会产生阴道局部刺激和阴道分泌物增多, 性欲降低, 性交疼痛, 阴道出血或乳房触痛, 疲劳, 瘙痒, 易怒和局部发热等。Archer DF等研究了10名绝经后妇女使用黄体酮阴道栓100 mg的药代动力学和临床安全性。给药后30min出现2例患者局部发热, 24 h后3例患者轻度腹绞痛, 5例患者感觉疲劳、头晕。研究过程中有2名妇女乳房胀痛, 5名妇女阴道出血。Pouly JI等比较了283例患者每日给药黄体酮阴道缓释凝胶(Crinone 8%) 与黄体酮胶囊(Utrogestan) 300 mg的临床安全性。结果发现, 黄体酮阴道缓释凝胶与黄体酮胶囊皆出现性欲降低, 性交疼痛, 易怒, 烦躁不安等不良反应。同时黄体酮阴道给药组伴有阴道刺激。
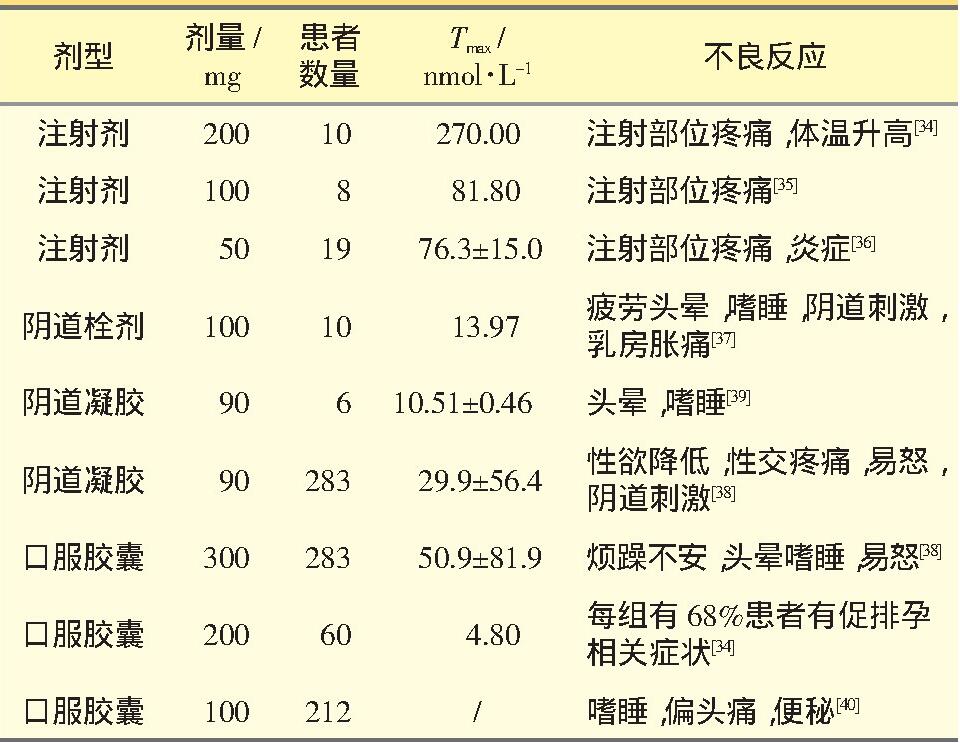
黄体酮口服制剂具有肝的“首过效应”, 导致生物利用度低。临床试验中使用口服黄体酮不会引起严重的不良事件。最常报道的不良反应为头晕或嗜睡, 可能与黄体酮代谢产物孕烯醇酮的轻度镇静作用有关。不同给药剂型临床安全性相关研究见表2。
五、黄体酮及其衍生物药代动力学研究
目前, 黄体酮(progesterone, 又称孕酮) 是黄体支持的首选药物, 自1934年黄体酮首先合成并上市出售以来, 临床主要用于先兆流产、胚胎移植、老年绝经患者黄体补充以及辅助生殖治疗等。根据结构通常分为黄体酮和黄体酮衍生物, 黄体酮衍生物又分为:17α-羟孕酮类(代表药物有醋酸甲羟孕酮、己酸羟孕酮、甲地孕酮) 和19-去甲睾丸酮类(代表药物有炔诺酮、烯诺孕酮、诺美孕酮) 。黄体酮衍生物相比于黄体酮副作用多, 但其效价高, 稳定性好, 因此临床应用非常广泛。黄体酮口服制剂使用方便, 但由于存在肝脏首过效应, 给药后血药浓度低, 妊娠率较低, 同时会有全身不良反应, 不适合用于辅助生殖技术中的黄体支持。黄体酮注射液(intramuscular progesterone, IMP) 为最常用的制剂剂型, 肌内注射后吸收完全, 2~8 h能达到有效的血药浓度, 不存在肝清除机制, 生物利用度高。最新研究显示, 黄体酮阴道缓释凝胶与IMP有着相似的临床疗效, 且副作用更小。
黄体支持是决定临床妊娠结局的重要环节, 正常女性黄体中期黄体酮血浆浓度大于10μg·L-1, 如果低于10μg·L-1常提示黄体功能不全, 小于5μg·L-1提示无排卵, 会导致不孕。由于孕期用药的安全性要求, 目前临床上可用于黄体支持的孕激素种类主要有注射、口服、阴道3种给药方式。目前, 有关黄体酮及其衍生物, 尚无明确的最佳给药方式、给药途径、剂量以及起始用药的最佳时机及持续时间等。
5.1 黄体酮及其衍生物传统药动学特点
5.1.1 吸收
黄体酮及其衍生物口服后主要经胃肠道吸收, 且吸收迅速。黄体酮经口服后血药浓度在3 h以内达到最高。醋酸甲羟孕酮(MPA) 经口服后2~4 h达到峰浓度(Cmax) , 且食物可促进MPA在体内的吸收, 提高生物利用度;在饭前或饭后服用MPA 10 mg, Cmax增加50%~70%, 生物利用度增加18%~33%。单次肌内注射己酸羟孕酮(17α-OHPC) 1.0 g后, 在未孕女性受试者中3~7 d后血清17α-OHPC达到峰值, 平均Cmax(±SD) 为27.8(±5.3) μg·L-1, 并且达峰时间(Tmax) 为4.6(±1.7) d。17α-OHPC的消除半衰期为7.8(±3.0) d, 13周后的谷浓度为60.0(±14) μg·L-1。炔诺酮(norethindrone) 口服后约2 h达到Cmax。黄体酮及其衍生物药代动力学参数见表1。
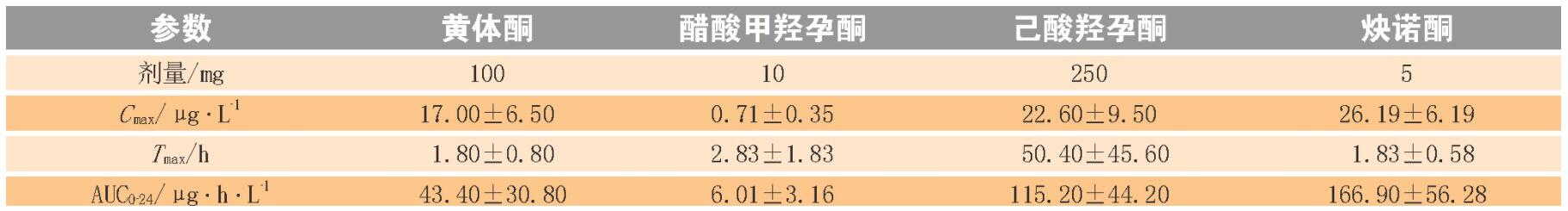
C max为达峰浓度;T max为达峰时间;AUC0-24为给药后0~24 h的时间-曲线下面积
5.1.2 体内分布
黄体酮及其衍生物口服吸收进入血液后主要与血清蛋白(大约有90%~99%) 结合。黄体酮主要与血清白蛋白(50%~54%) 和皮质类固醇结合球蛋白(43%~48%) 结合;MPA吸收进入血液主要与血清白蛋白结合, 表观分布容积(Vd) 为(4.06±3.83) L·kg-1;17α-OHPC在体内分布与黄体酮、MPA类似, 主要与血清蛋白相结合;炔诺酮61%与血清白蛋白结合, 炔诺酮36%与性激素结合球蛋白(SHBG) 结合, Vd约为4 L·kg-1。
5.1.3 代谢
黄体酮口服吸收后主要由肝脏代谢, 代谢产物主要为孕二醇和孕烯醇酮, 孕二醇和孕烯醇酮在肝脏中转化为葡萄糖苷酸和硫酸盐代谢物。经胆汁排泄的黄体酮代谢物可以被解离, 并且能通过还原、脱羟基化和差向异构化进一步在肠中代谢。MPA口服后经羟基化在肝脏中被CYP450酶代谢, 其代谢主要涉及环A或侧链还原、脱乙酰基等, 代谢产物主要为葡萄糖苷酸和硫酸化物。
体外研究表明, 17α-OHPC可以通过Ⅰ相和Ⅱ相反应被肝细胞代谢, 主要由CYP3A4和CYP3A5酶介导。17α-OHPC在体内经过还原、羟化和共轭, 产生的代谢物包括葡萄糖苷酸化产物、硫酸化产物和乙酰化产物。炔诺酮代谢与17α-OHPC类似, 代谢物主要为葡萄糖苷酸化产物、硫酸化产物。
5.1.4 排泄
黄体酮经口服吸收后在胆汁和尿液中以葡萄糖苷酸和硫酸化物的形式排泄;经胆汁排泄的黄体酮代谢物可能会发生肠肝循环。MPA的代谢物主要以葡萄糖苷酸的形式经尿液排泄, 只有少量以硫化物排泄。17α-OHPC产生的代谢物和游离类固醇经尿液和粪便排泄。妊娠10~12周对孕妇进行肌内注射17α-OHPC后, 粪便排泄约50%, 尿液排泄约30%。炔诺酮代谢物经粪便和尿液排泄, 血浆清除率约为0.4 L·h-1·kg-1。
5.2 黄体酮临床药代动力学研究
5.2.1 给药途径对药代动力学的影响
黄体酮口服后经胃肠道迅速吸收, 口服后2~4 h达到最大血药浓度, 第2次给药(口服一般1日2次, 间隔约12 h) 后可很快达到稳态血药浓度。但由于黄体酮主要在肝脏代谢, 其绝对生物利用度低, 仅为6%~8%, 这与首过效应有关, 因此黄体酮口服制剂不适用于体外受精(IVF) 中的黄体支持。在不同口服制剂的药代动力学研究中, 黄体酮的血浆水平在24 h内均恢复到基线值, 曲线下面积(AUC) 无显著差异。口服制剂的药代动力学受食物影响, 食物可能通过降低胃排空速度、胃肠动力, 增加胃肠分泌物和增加内脏血流量来影响黄体酮吸收的速度和程度。研究表明, 食物能够促进黄体酮口服后在胃肠道的吸收。
黄体酮阴道缓释凝胶具有持续释放的性质, 在体内吸收延长, 吸收半衰期约为25~50 h, 消除半衰期为5~20 min, Cmax为7~20μg·L-1。黄体酮阴道缓释凝胶可避免口服制剂的首过效应问题, 在24 h内产生更稳定的血清孕酮浓度, 其在体内与血清蛋白(96%~99%) 广泛结合, 主要结合蛋白为血清白蛋白和皮质类固醇结合球蛋白。阴道缓释凝胶的主要代谢产物为5β-孕烷-3α, 20α-二醇葡萄糖苷酸, 仅存在于血浆中。相比于口服给药制剂, 黄体酮阴道缓释凝胶在体内代谢产物更少, 无镇静、嗜睡等副作用。
黄体酮栓剂经阴道吸收后约有50%~75%的药物不经肝脏而直接进入体循环, 避免了肝脏首过效应。研究显示, 35例健康排卵女性(平均年龄31岁) 给予黄体酮阴道栓后, 血清孕酮浓度在给药后2~3 h内达到最高水平, 单次给药25、50 mg的Cmax分别为(7.27±2.8) 、(8.84±3.14) μg·L-1。Levy等对黄体酮阴道片在健康绝经后妇女体内的药代动力学研究结果显示, 黄体酮阴道给药100 mg其Cmax达到(10.13±4.04) μg·L-1, Tmax为(6.4±3.35) h;给药50mg后Cmax为(6.55±2.57) μg·L-1, Tmax为(6.1±2.63) h, 表明黄体酮阴道片用于辅助生殖, 每次应至少给药100mg(1日2次) 。
肌内注射黄体酮注射液10 mg, 注射后在8 h内达到Cmax(均值7μg·L-1) , 且血浆浓度保持在基线以上约24 h;同时注射10、25和50 mg剂量后产生Cmax的平均值分别为7、28和50μg·L-1。黄体酮注射液主要经肝脏代谢还原为孕二醇、孕烯醇酮, 随后偶联化形成葡萄糖苷酸和硫酸盐代谢物, 主要在粪便排泄。研究显示, 黄体酮注射液在女性体内平均血浆代谢清除率为(2 510±135) L·d-1。
Norman等比较了黄体酮口服和阴道给药在健康绝经后女性受试者体内的生物利用度发现, 口服给药后4 h内黄体酮血浆浓度达到峰值, 范围为8.5~70.6μg·L-1;而阴道给药后, 在8 h内达到峰值, 范围为4.4~181.1μg·L-1;另外Cmax也存在着相当大的个体差异现象。
Ho等研究显示, 每日2次黄体酮阴道缓释凝胶(90 mg, 妊娠率56.7%) 用于黄体支持比黄体酮注射液(50 mg·d-1, 妊娠率35.1%) 有更好的妊娠结果。黄体酮阴道给药和肌内注射的药代动力学特征差别较大:肌内注射可产生高血浆水平和低子宫内膜水平的孕酮浓度, 但阴道缓释凝胶与此相反, 能产生低血浆水平和高子宫内膜水平的孕酮浓度。另有研究认为, 尽管阴道给药的血清孕酮水平较低, 但是阴道局部的高浓度孕酮能够诱导子宫内膜间质实现完全分泌性转化, 从而提高体内黄体水平, 促使子宫内膜成熟、剥脱并维持月经周期。因此, 黄体酮阴道缓释凝胶的局部高浓度效应更加适用于临床治疗。
多项比较黄体酮阴道缓释凝胶雪诺同®8%(Crinone8%, 90 mg) 、黄体酮胶囊(Prometrium®, 100 mg) 与黄体酮阴道栓剂(Endometrin®, 100 mg) 的药代动力学研究结果显示, 黄体酮阴道给药相比于黄体酮口服给药血药浓度和生物利用度更高(见表2) 。另有比较黄体酮栓剂和黄体酮缓释凝胶阴道给药的药代动力学研究结果显示, 阴道栓剂和阴道缓释凝胶通常安全且耐受性良好, 但黄体酮栓剂的血药浓度相对更高。Corleta等研究显示, 黄体酮阴道栓剂Cmax为(8.84±3.14) μg·L-1, 低于雪诺同®8%[Cmax为(10.51±0.46) μg·L-1], 且黄体酮阴道缓释凝胶给药后血药水平持续时间更长, 不同患者吸收相对差异小, 因此临床应用更为广泛。

C max为达峰浓度;T max为达峰时间;AUC0-24为给药后0~24 h的时间-曲线下面积
5.2.2 剂量对药代动力学的影响
Simon等将15例女性受试者随机分成3组, 分别服用微粉化黄体酮100、200、300 mg, 于0、1、2、3、4、6、10和24 h抽取血液测定血清孕酮浓度:口服给药微粉化黄体酮100、200、300 mg后Cmax分别为(6.5±1.8) 、(13.8±2.9) 、(32.3±7.8) μg·L-1, 平均半衰期分别为(2.7±1.0) 、(2.2±1.4) 、(2.0±1.4) h, 认为黄体酮微粉化后吸收和消除符合一级动力学, 并且100~300mg之间药代动力学无剂量依赖性。
在单剂量交叉研究中, 20例健康的绝经后妇女分别接受黄体酮阴道缓释凝胶雪诺同®4%(Crinone 4%, 45 mg) 和雪诺同®8%, 其药代动力学参数见表3。结果表明:给药剂量对药代动力学参数具有一定影响, 随着给药剂量增大, Cmax增大, 达峰时间Tmax延长, 但无显著性差异, 平均血药浓度Cavg 0-24相对平稳, 表明黄体酮在体内的吸收和消除与剂量无关, 即不同剂量的黄体酮给药不会产生显著的药代动力学差异。此外, 当全剂量每日施用1次或半剂量每日施用2次时, 24 h内AUC相似;尽管血浆中黄体酮水平有波动, 但靶组织、子宫内膜中的浓度保持相对不变。因此, 治疗剂量应以实际临床情况进行选择。
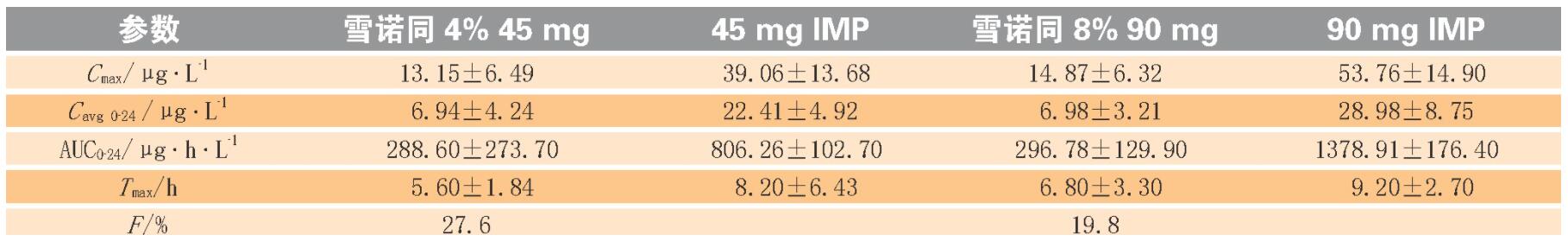
C max为达峰浓度;T max为达峰时间;AUC0-24为给药后0~24 h的时间-曲线下面积;Cavg 0~24为24 h平均浓度;F为相对生物利用度
5.2.3 给药时间对药代动力学影响
长期临床用药发现, 不同给药时间影响药物的吸收、代谢以及不良反应等。Wu等研究了24例绝经后妇女分别每日1次和每2日1次服用微粉化黄体酮制剂雪诺同®8%的差异, 在0、15、30、45、60、120、240、480和1 440 min后测定血清孕酮浓度, 治疗结束时收集子宫内膜样品;结果显示, 每日给药1次和每2日给药1次后, 雪诺同®8%Tmax均为5 h, 平均血药浓度分别为4.52、3.47μg·L-1, 表明每日给药1次与每2日给药1次药动学结果相似, 血浆浓度均以双相方式下降, 分布阶段快, 消除阶段缓慢;试验也表明黄体酮阴道缓释凝胶在体内无蓄积。
一项比较不同规格黄体酮阴道缓释凝胶(雪诺同®4%和雪诺同®8%) 以及同给药方式的药代动力学研究结果显示, 每日2次雪诺同®8%有着较高的平均血药浓度, 能够达到较好的临床治疗效果(见表4) 。另有研究证实, 虽然肌注黄体酮血浆浓度高, 但黄体酮阴道缓释凝胶在子宫内膜中孕酮浓度更高。因此, 每日2次黄体酮阴道缓释凝胶用于黄体支持比肌注黄体酮有更好的妊娠结果。
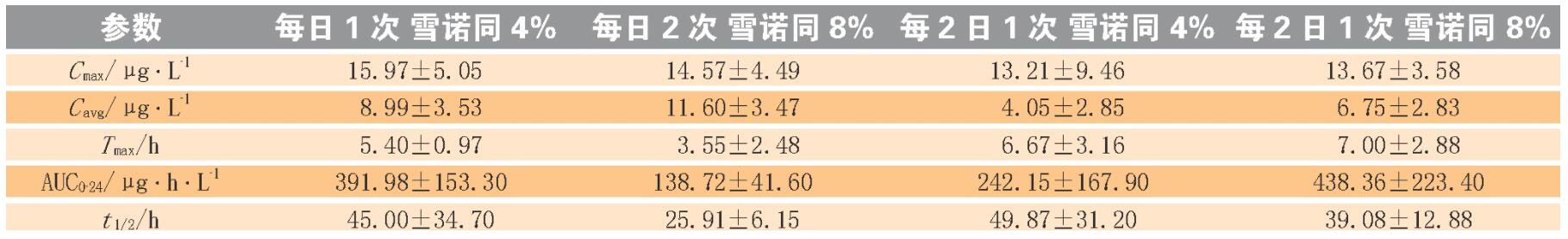
C max为达峰浓度;T max为达峰时间;C avg为平均浓度;t 1/2为半衰期;AUC0-24为给药后0~24 h的时间-曲线下面积
5.3 黄体酮其他药代动力学特点
5.3.1 联合用药
研究显示, 雌激素可显著增加黄体酮在阴道内的吸收, 提高子宫内膜的保护能力和不孕症的临床治疗效果。Shu等证实, 含有乙炔雌二醇6 mg和微粉化黄体酮50 mg的联合阴道片剂在黄体中期产生的血浆孕酮浓度为(21.6±2.5) μg·L-1, 高于单独使用微粉化黄体酮[(8.84±3.14) μg·L-1]。James等将17β-雌二醇2 mg和黄体酮200 mg混合胶囊给药于62例绝经后妇女发现, 平均Cmax达到89.2μg·L-1、Tmax为3.0 h、AUC0-t为120.1 mg·h·L-1, 认为雌二醇与黄体酮相结合的口服剂型促进了黄体酮的吸收, 同时能够达到药物临床治疗所需血药浓度, 因此是一种安全有效的临床替代方案。
3.2 特殊人群用药
黄体酮在体内的代谢排泄受肝脏、肾脏影响较大, 但在肝肾功能不全患者体内的药代动力学研究上目前上市的诸多黄体酮制剂报道少见。对于肾功能不全患者, 黄体酮可能会导致一定程度的体液潴留, 故临床应慎用;对于肝脏功能障碍或疾病患者, 禁用黄体酮。
有研究表明, 中老年女性相比于年轻女性, 黄体酮在阴道中吸收速率增强, 100 mg剂量半衰期分别为(5.89±3.25) 、(7.25±3.50) h;在雌激素引发后也显示出吸收延迟。据推测, 这种现象与中老年女性的阴道黏膜萎缩有关。
六、黄体酮的新剂型及其相关应用
目前,市场上的黄体酮可以通过不同的途径给药,应用较多的是口服、阴道、注射、皮肤给药,主要的口服给药方式有胶囊、胶丸、片剂,注射给药方式有油性注射剂,阴道给药方式有凝胶剂、栓剂、阴道环,皮肤给药方式有软膏。临床上应用较多的剂型为注射剂、阴道缓释凝胶、口服胶囊等。
6.1 已上市的黄体酮制剂
6.1.1 注射剂
目前,市面上的黄体酮注射液主要是由天津金耀药业有限公司、广州白云山明兴制药有限公司、浙江仙琚制药股份有限公司、上海通用药业股份有限公司生产。黄体酮注射液肌肉注射后在肝内代谢,约12%代谢为孕烷二醇,代谢物与葡萄糖醛酸结合随尿排出,注射100 mg,6~8 h血药浓度达峰值后逐渐下降,可持续48 h,72 h消失。治疗不同病症用法用量不同,主要用于月经失调、黄体功能不足、功能性子宫出血和习惯性流产、经前期紧张综合征的治疗。黄体酮油性注射剂存在以下缺点:(1)孕妇需常去医院注射,顺应性差,奔波劳累,不利于保胎;(2)使用注射器吸取黄体酮进行肌肉注射,吸入及推入时有一定的阻力,有操作难度;(3)肌肉注射时有较大的刺激性,患者感到疼痛与不适,给临床使用带来不便;(4)注射剂的溶媒是大豆油,存在毒副作用,如注射部位会出现疼痛、发炎、硬结和局部变态反应、影响药物吸收,一定程度上影响了生物利用度。
6.1.2 口服胶囊
口服胶囊缺点是存在肝脏首过效应,血药浓度低,生物利用度低。目前,黄体酮胶囊主要有浙江爱生药业有限公司的琪宁、浙江仙琚制药股份有限公司的益玛欣、浙江医药新昌制药厂生产的来婷和法国法杏大药厂生产的安琪坦等4种产品。该4种胶囊的规格除了益玛欣为50 g外,其余皆为100 g,口服后1~3 h血药浓度达到峰值,主要在肝内代谢,最终随尿液与粪便排出;均用于治疗先兆性流产和习惯性流产、经前期紧张综合征、排卵机能障碍引起的月经失调、与雌激素联合使用治疗更年期综合征。安琪坦胶囊还可用于阴道给药。
6.1.3 阴道给药的制剂
6.1.3.1 阴道缓释凝胶
目前,上市的黄体酮阴道缓释凝胶有Fleet Laboratories Ltd的雪诺同crinone,规格为8%(90 mg),仅供阴道使用,赋形剂有甘油、轻状液体石蜡、氢化棕榈油甘油酯、聚卡波非、卡波姆974P、氢氧化钠、山梨酸和纯水,主要用于辅助生育技术中黄体酮的补充治疗。由于雪诺同连续释放的特点,使得黄体酮的吸收时间延长,吸收半衰期约为25~50 h,而清除半衰期为5~20 min,所以,雪诺同的药动学特征受吸收率的影响大于清除率。雪诺同有以下优点:第一,相比于注射剂,阴道缓释凝胶使用起来更方便,患者可以自行完成给药、不必往返于医院与家之间,也不必承受由于注射带来的疼痛;第二,缓释凝胶雪诺同有“子宫首过效应”,阴道给药后,经阴道黏膜吸收,进一步扩散到宫颈、宫体,完成从子宫内膜向基质的扩散,在子宫局部能稳定在较高浓度,并且吸收入血的比例低,有效降低了全身毒副作用发生的风险。但是,雪诺同也存在缺点,即患者易出现阴道分泌物增多、阴道瘙痒等不良反应,且价格昂贵。
6.1.3.2 栓剂
目前,市场上主要的黄体酮栓剂由湖北东信药业有限公司生产,商品名为静青,规格为25 mg。黄体酮栓剂在阴道黏膜吸收迅速,约2~6 h血药浓度达峰值,在肝内代谢,约12%代谢为孕烷二醇,代谢物则与葡萄糖醛酸结合随尿排出。另一种已上市的天然黄体酮栓剂——Cyclogest progesterone ,规格为400 mg,为英国Actavis(阿特维斯)制药有限公司所生产,可供阴道与直肠使用。黄体酮栓剂的缺点是在阴道融化后容易流出,影响疗效。
6.2 在研制剂
6.2.1 新剂型
6.2.1.1 温敏凝胶剂
黄体酮阴道缓释凝胶是一种长效制剂,是把微粉化后的黄体酮均匀的混悬在以卡波姆等为基质的凝胶中制备而成。2014年,林佳源等制备温敏型黄体酮原位凝胶,确定最优处方为:黄体酮4.0%、泊洛沙姆407 20%、甘油5.0%、液体石蜡5.0%、油酸聚乙二醇甘油酯2.0%、聚卡波非0.2%、山梨酸0.08%、分散介质为0.1 mol/L的枸橼酸磷酸盐缓冲盐(pH=4.0),胶凝温度为33.8 ℃。与一般黄体酮凝胶相比,温敏凝胶中的药物释放较快,在温敏原位凝胶中黄体酮的释药符合一级动力学特征。阴道用温敏原位凝胶具有良好的铺展性、黏膜覆盖面积大、滞留时间长、使用方便。2015年,王梅等研究天然黄体酮凝胶的制备,选用卡波姆-940为凝胶剂的基质,通过正交试验,以黏度、触变性、屈服值为指标,筛选最佳处方。所得处方外观乳白色,黏度适中,粒径分布均匀;药效检测具有一定的孕激素活性,能促进兔子宫内膜发育。
6.2.1.2 阴道环
阴道环是一种圆环状、柔韧、有弹性的装置,主要以硅橡胶弹性体与热塑性材料作为材质,能长期缓慢地将药物释放到阴道,起到局部或者全身治疗作用。黄体酮阴道环(PVR)是美国人口理事会与几个国家的科学家和合作者合作开发的,是一种专为哺乳期妇女设计的用于延长哺乳期闭经和促进生育间隔的新型避孕药物,黄体酮阴道环由硅酮弹性体和分散在环基体中的黄体酮组成。此阴道环每天提供黄体酮10 mg,可连续使用3个月(90 d),患者可连续使用1 a(连续使用4个阴道环)。PVR目前在智利和其他几个中美洲和拉丁美洲国家注册,品牌名称为Progering,主要用于妇女产后避孕。周用黄体酮阴道环目前尚未获得FDA批准,但已被证明是其他形式的阴道给药黄体酮的一种有效和安全的替代品,用于接受体外受精的女性进行黄体补充。阴道环黄体支持更方便,副作用更少,妇女们使用阴道环持续1周,并允许每天一次最长可取出1 h,且没有任何阴道环流出或者放置困难的问题。黄体酮阴道环用于哺乳期的母亲避孕时,由于口服给药半衰期短,婴儿摄入的剂量远低于安全阈值,因此阴道环对于母乳喂养的婴儿是安全的,其生长率与母亲使用宫内节育器避孕的婴儿相比没有差异。
2016年,姚小东等采用注塑成型法制备黄体酮储库型阴道环药芯,加热硫化法包裹控释膜,通过单一变量法以7 d的释放行为作为标准考察影响药物释放的因素,相对于黄体酮基质型阴道环,储库型阴道环能够大大降低第1天突释量,使药物的释放更加平稳。黄体酮储库型阴道环可以通过调节载药量、处方添加物组成、控释膜厚度和阴道环结构来达到理想的药物控制释放效果。2006年,孔雅慧等研究黄体酮阴道环在家兔中的药动学,将18只去卵巢后2周的新西兰雌兔随机分为低剂量组(175 mg)、高剂量组(350 mg)和肌注组,分别在放置阴道环及肌注黄体酮前后不同时点取静脉血,用磁性分离酶联免疫法测定兔血清中黄体酮的浓度, 用PK-Graph程序计算药动学参数。结果显示,与传统的黄体酮注射剂相比,黄体酮阴道环的药动学参数呈现明显的长效缓释特性,应可成为安全长效且使用方便的哺乳期避孕工具。邱顺晨等研究阴道环中药物在硅橡胶中的溶解度及扩散系数与药物释放速率的具体关系,指出黄体酮阴道环中药物释放速率由溶解度与扩散系数共同决定。调节药物释放速率,需要综合考虑药物的溶解度及各类添加剂对扩散系数的影响等多方面因素。
6.2.1.3 缓释栓剂
黄体酮栓剂的基质通常使用脂肪酸与可可豆脂,但这类制剂通常很快融化,然后从阴道渗漏弄脏病人的衣服,尤其是病人打喷嚏和咳嗽的时候。而且,该制剂溶解速度太快,会大大降低生物利用度。2006年,龙利红等研究制备了黄体酮缓释栓剂,并考察其家兔药动学,以体外释放度为指标、采用正交设计法优化处方,结果显示体外释放行为符合零级动力学,体外过程为二室模型,药动学参数显示该制剂具有缓释特性。
6.2.1.4 亚微乳注射剂、纳米晶注射剂
亚微乳作为一种新型药物的给药系统,具有载药量大、毒副作用小、靶向、缓释、控释等特点。把黄体酮制成亚微乳注射剂,可增加药物的稳定性、有利于吸收、提高了生物利用度,且可避免油性注射剂的疼痛和过敏现象,减少毒副作用,提高患者的依存性。2014年,翟宇等利用高压均质法制备黄体酮亚微乳注射剂,通过正交试验优化处方,通过粒径、Zeta电位及黏度等指标考察亚微乳的性质,结果显示所制备的黄体酮处方和制备工艺可行,能够达到静脉注射的目的。2017年,李莉等制备了黄体酮纳米级、微米级注射液,两者在PBS溶液中释放达到90%时分别需要2 h和4 h,而黄体酮原料药释放完全需要近40 h。在药动学试验中,相比于市售黄体酮注射液,黄体酮纳米级和微米级注射液的Cmax分别提高了1.8倍和1.7倍,AUC0-t分别提高了2.96倍和1.63倍,两者的释放速率和生物利用度均高于黄体酮注射液。
6.2.1.5 透皮制剂
透皮给药系统使得药物以恒定速率通过皮肤进入体循环作用于全身或局部,其优点为药物的吸收不受消化道内酸碱性、转运时间等因素影响,避免肝脏首过效应,控制给药速度,给药灵活等。RUAN Xiangyan提倡黄体酮通过皮肤给药,指出黄体酮制成乳膏应用于皮肤时,对更年期症状、骨质疏松、癌症和子宫疾病有许多积极的作用。Holzer G等研究结果表明,外用2%黄体酮乳膏可增强绝经期和绝经后妇女皮肤的弹性和紧致度,加上黄体酮乳膏良好的耐受性,使黄体酮成为一种减缓绝经后女性皮肤老化可能的治疗手段。俞佳等采用聚丙烯酸酯为骨架制备黄体酮透皮贴片,以离体人皮为透皮模型,采用Valia-Chien扩散池和高效液相色谱法研究促渗剂、药物含量对黄体酮透皮给药系统经皮渗透的影响,结果显示单月桂酸甘油酯和棕榈酸乙酯联和应用可显著促进黄体酮体外经皮渗透,黄体酮的最佳含量是1.0 mg/cm2。
6.2.1.6 鼻腔给药
鼻内给药是一种比较有前途的治疗方法,鼻内给药无创、无压力、无痛、操作方便。重要的是,鼻内给药适用于紧急情况,如中风和创伤性脑损伤。有研究报道,短暂局灶性脑缺血后经鼻给药黄体酮,一来可以改善运动功能;二来减少梗死体积、神经元丢失、血脑屏障破坏;三来可以减少大脑线粒体功能障碍,表明经鼻给药黄体酮是一种潜在的高效的、安全的给药方式,值得对脑损伤患者的脑保护进行评估。
6.2.2 制剂中间体
6.2.2.1 脂质体
脂质体是将药物包封于类脂质双分子层薄膜中间所制成的超微球状载体制剂,能够靶向、缓释、提高药物稳定性、降低药物毒性、提高生物利用度。2011年,王梅等采用一种新型前体脂质体制备方法,用黄体酮、磷脂、PEG-400、丙二醇、制备了黄体酮前体脂质体,再进一步灌装于软胶囊壳中,制成黄体酮前体脂质体口服软胶囊制剂。采用葡聚糖Sephadex G-50凝胶柱对黄体酮脂质体进行柱分离测定其包封率,结果显示包封率与稀释倍数和药脂比有关,当稀释倍数为1∶10、药脂比为1∶20时,黄体酮前体脂质体包封率可达到(72.36±11.69)%。2012年,高晓黎等采用caco-2细胞模型考察黄体酮及其脂质体的转运,考察转运时间、药物浓度及抑制剂对黄体酮转运的影响,结果显示黄体酮的吸收受P-糖蛋白的介导,这可能是导致其生物利用度低的原因之一。黄体酮属生物药剂学分类系统中Ⅱ类药物,提高溶解度可提高其生物利用度,黄体酮脂质体通过改变黄体酮的吸收机制,使黄体酮以被动扩散方式进行转运,从而明显促进黄体酮的吸收。2017年,WANG Mei等根据黄体酮与胆固醇的结构相似性质,制备了壳聚糖包被的无胆固醇修饰的黄体酮脂质体,平均包封率达80%,体外释放曲线显示出缓释作用,体外稳定性评价显示能有效保护黄体酮不被胃肠道黏膜降解,相对生物利用度高于黄体酮软胶囊与黄体酮脂质体,提示壳聚糖包被的无胆固醇修饰的脂质体是提高黄体酮口服生物利用度的一个很有前途的选择。
6.2.2.2 固体脂质纳米粒、纳米结构脂质载体
纳米结构脂质载体是一种新型的脂质纳米粒,以几种熔点不同的固液脂质混合物作为基质,液态脂质的存在可紊乱固态脂质的晶型结构,提高纳米粒的药物负载能力。另一方面,由于大多数药物在液态脂质中的溶解度要高于在固态脂质中的溶解度,从而有利于对药物的包封。2008年,王蕾蕾等以黄体酮为模型药物,硬脂酸和单硬脂酸甘油酯为固体脂质,油酸为液态脂质,采用熔融乳化法制备黄体酮纳米结构脂质载体。用此法可得到稳定的黄体酮纳米结构脂质载体,药物体外释放可以持续24 h,具有较高的包封率和明显的缓控释性能。大鼠口服黄体酮脂质纳米粒后的血药浓度-时间曲线提示,脂质纳米粒延缓药物的达峰时间,并明显提高药物的生物利用度。热均质技术是目前应用最广泛的纳米粒子制备方法,该方法是在高剪切混合装置的搅拌下,将熔融的脂质相分散在热的表面活性剂水溶液中。然后将得到的乳液进行热均化和冷却,最后,再通过脂质重结晶得到纳米颗粒。2017年,Elisabetta Esposito等利用高压均质化生产的纳米结构脂质载体黄体酮和固体脂质纳米粒黄体酮均具有良好的物理与化学稳定性,在生产后6个月的时间里,粒子均一且无团聚现象,两者均具有较高的包封率。
6.2.2.3 微球
微球是指药物分散或者吸附在高分子聚合物基质中而形成的微小球状实体,粒径一般为1~250 μm,具有靶向性、缓释性及长效性,可以提高药物的稳定性,适用于口服、注射等多种途径。2011年,高豪等采用乳化溶剂蒸发法制备黄体酮聚乳酸微球,扫描电镜下的微球光滑、均匀、球形圆整、分散性好,包封率为(80.00±1.60)%,载药量为(10.63±0.05)%,7 d内累积释药量为53.41%,表明制备的微球载药量好、包封率高、有明显的缓释效果,为进一步研发长效缓释的新剂型提供了试验依据。2001年,冯敏等用阴离子聚合法合成聚谷氨酸苄酯-谷氨酸甲酯共聚物(PBMG),用溶剂挥发法制备以PBMG为载体的黄体酮微球并考察微球的释药特性,结果显示油水相之比、乳化时间、乳化速度是影响粒径大小的主要因素,聚合物组成和释药介质均影响药物微球的释药速率。2018年,YE Mingzhu等采用溶剂蒸发法制备黄体酮-PLGA微球,利用高温以及磁搅拌预测长效黄体酮微球的释放。该方法是预测和推导释放功能的一个很好的方法。Turino等用PLGA 502 H(聚乳酸-羟基乙酸共聚物)、三丙酮和聚乙烯醇水溶液制备黄体酮-PLGA微球,此微球可以控制释放黄体酮近5 d。
6.2.2.4 包合物
环糊精包合物是药物分子在环糊精的空穴结构内被全部或部分包含形成的一种特殊的复合物,可以提高药物稳定性、增大溶解度,以及使液体药物粉末化,提高药物的生物利用度、降低毒副作用与药物刺激性。2003年,王宪英等采用共沉淀法制备黄体酮β-环糊精包合物,黄体酮与β-环糊精的配比为1∶2,包和时间为4 h,包和温度为40 ℃,得到包合物的平均质量分数为13.68%,溶解度及溶出度测定结果表明,包合物可以明显提高黄体酮的溶解度及溶出度,这为黄体酮β-环糊精进一步制成其他制剂提供了依据。
七、小结
黄体酮作为内源性激素, 其安全性高于其衍生物, 具有广阔的应用前景, 目前使用较多的有妇科领域和辅助生殖领域。黄体酮临床应用副作用少, 主要与给药途径相关, 黄体酮的给药途径主要有口服、经皮、肌注、阴道给药等。口服、经皮与阴道给药安全性高于肌内注射;但口服、经皮给药生物利用度低, 故临床应用受到限制。黄体酮肌内注射吸收效果好, 在肝脏内代谢, 疗效肯定;但需多次往返医院注射, 也因其为油性制剂, 长期肌内注射可导致注射部位过敏反应及无菌脓肿形成。黄体酮阴道给药已经成为常用给药途径的一种, 患者可自行完成, 吸收充分且无痛苦, 患者间吸收差异性较小, 缺陷为价格较高。
黄体酮及其衍生物不同给药剂型的药代动力学差异较大, 临床应用需结合患者实际情况进行选择。在用药前应仔细询问患者的过敏史并检查患者的肝肾功能。新一代黄体酮衍生物效价高、稳定性好, 其制剂患者依从性好, 但易产生副作用, 故临床应慎用。黄体酮口服制剂由于吸收后存在肝脏首过效应, 血药浓度低, 因此临床适用于黄体功能不足症状较轻患者。目前, 使用和研究较多的剂型为黄体酮阴道缓释凝胶和肌内注射液, 且有研究证实黄体酮阴道给药与肌内注射给药在提高临床妊娠上的疗效是相似的。黄体酮肌内注射液生物利用度高, 是目前国内和美国辅助生殖技术中黄体支持的主要给药途径;其吸收效果好, 血药浓度高, 在肝脏内代谢, 疗效肯定, 但缺点是需要多次往返医院注射, 也因其为油性制剂, 长期肌内注射可导致注射部位过敏反应及无菌脓肿形成。因此, 黄体酮肌内注射临床适用于黄体功能严重不足或口服、阴道给药吸收效果较差患者。黄体酮阴道给药已经成为常用给药途径的一种, 患者可自行完成, 吸收充分, 且能够避免肝脏首过效应。黄体酮阴道缓释凝胶由于其持续释放特点, 可使黄体酮吸收时间延长。黄体酮阴道缓释凝胶每日给药2次能够产生明显高于子宫内膜的孕激素水平;相比于其他阴道剂型, 优点还有释药持久和不同患者吸收差异小、临床适用范围广等, 但起效较慢, 对于黄体功能严重不足患者应联合雌激素治疗。
黄体酮的现有剂型有阴道凝胶剂、阴道栓、注射用油性注射液、口服胶囊、口服胶丸,新的剂型有阴道环、鼻腔给药制剂、注射用脂质体、微球、纳米粒、皮肤递药制剂等。开发新的剂型可以改善现有制剂的缺点,增加黄体酮的生物利用度。
近年来黄体酮新型递送系统的研究取得了较大的进展, 通过剂型改造, 可提高黄体酮的溶解度和稳定性, 很大地提高黄体酮在体内的生物利用度而减少其毒副作用。例如脂质体、纳米粒等微载体药物递送系统及阴道缓释给药剂型的持续深入研究, 因此, 方便有效的黄体酮制剂有望进入临床。