聚山梨酯在生物制剂中的过敏反应
单克隆抗体(MAb)在治疗肿瘤、自身免疫和炎症疾病中的使用迅速增加,导致全球超敏反应急剧增加,使MAb作为一线治疗的使用变得复杂,并限制了患者的生存和生活质量。过敏反应的起源尚不清楚,但其机制相当简单(如下图1)。通常归因于生物治疗剂的一些未知的内在特性—尽管事实上生物治疗剂配方很复杂,并且包含许多功能性赋形剂。配方中的这些辅料有助于药物产品应对保质期、稳定性、溶解性、冻干后重构以及蛋白质聚集等严峻挑战—尤其是在高浓度单抗制剂中,为了减少MAb给药量和减少给药频率的,配方中的辅料成分会较为复杂。
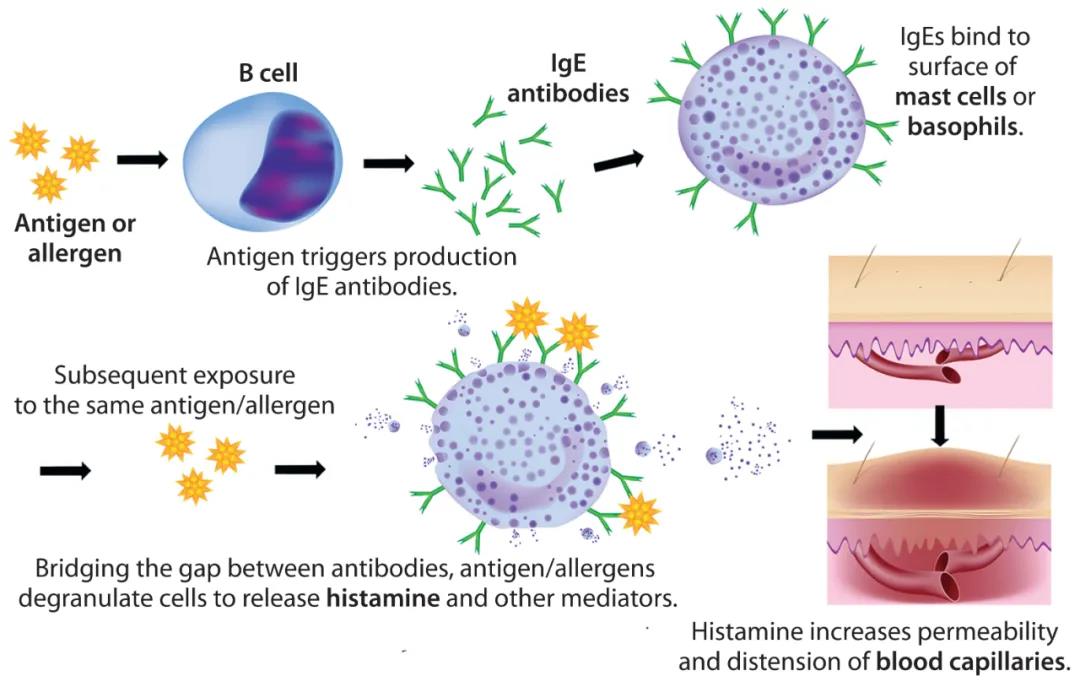
图1:过敏反应
大约70%的MAb制剂包含PS-20或PS-80。聚山梨酯(Polysorbate,PS)表面活性剂就是这样的一类赋形剂,可掺入许多生物治疗剂中,以防止蛋白质聚集和相关的功效受损。尽管聚山梨酯在该作用中的表现是有效的,但它们含有醚键(在聚氧乙烯部分内)和不饱和烷基链,这些链在水溶液中自发氧化形成免疫原性和过敏性化学物质,包括过氧化物和烷基过氧化物、环氧酸和反应性醛类,如甲醛和乙醛。聚山梨酯还在水溶液中水解以释放游离脂肪酸,从而增加溶液浊度。在批次间差异中化学活性物质(例如过氧化物)的浓度也会超过一个数量级。
生物治疗药物的免疫原性是美国食品和药物管理局(FDA)和欧洲药品管理局(EMA)日益关注的一个严重问题。它将继续对生物仿制药和新型创新生物治疗药物的开发和监管批准产生重大且不断增长的影响。
另一方面,过敏反应是一种应激反应,虽然严重程度不同,但有时发生的过敏情况会很严重,通常过敏反应被忽视,并认为是生物治疗蛋白本身不可避免的特性。在实际的药物研究中过敏物质很少或根本没有区分和分离其在生物制剂中的实际来源。虽然聚山梨酯不会发生诱导免疫原性是有据可查的,所以聚山梨酯诱发的过敏反很少受到人们的重视。监管机构在评估生物仿制药时非常重视可以比较原研药和仿制药的功效。但相似的功效并不一定意味着原研药和生物仿制药之间的安全性就一定相似。免疫原性和过敏反应均应构成生物治疗药物安全性评估的主要组成部分。

过敏反应通常发生迅速,并在数分钟至数小时内就会出现临床症状。在某些情况下,它可能会导致死亡。潜在机制是某些类型的白细胞释放多种类型的介质,可由免疫或非免疫机制触发。最常见的原因包括昆虫叮咬、食物过敏和药物治疗。
在后一类中,常用的聚山梨酯赋形剂PS-80和PS-20存在于超过70%的MAb和其他蛋白质生物治疗剂中,现在它们已被证明会导致接受这些药物的患者出现过敏反应。过敏反应症状会在几分钟到几小时内发生,如果通过静脉接触,平均会在5-30分钟内发生,影响皮肤、呼吸系统、胃肠道、心脏和脉管系统以及中枢神经系统。症状包括荨麻疹、瘙痒、潮红或肿胀(血管性水肿);舌、喉和咽部水肿;流鼻涕,结膜水肿。可能的呼吸道症状包括气短、支气管痉挛和继发于肿胀的上呼吸道阻塞。冠状动脉痉挛可能与血压下降或休克有关,有时会导致随后的心肌梗塞、心律失常或心脏骤停。过敏反应的治疗包括让患者平躺并给予抗组胺药、类固醇、静脉输液和肌肉注射肾上腺素。
在生物治疗药物中,已经报道了多种MAb药物超敏反应和过敏反应,包括:rituximab、 ofatumumab、obinutuzumab、trastuzumab、cetuximab、tocilizumab、infliximab、etanercept、adalimumab、abciximab、golimumab、certolizumab、brentuximab、bevacizumab、omalizumab这些单抗产品中都使用表面活性剂聚山梨酯配制。
聚山梨醇酯的化学性质
聚山梨酯在生物治疗制剂中发挥着积极作用。在制剂中可以防止聚集—这一点非常重要,因为聚集的蛋白质具有免疫原性,可以诱导患者免疫系统产生中和抗体,从而降低或消除给药的有效性。然而,需要解决与聚山梨酯相关的许多缺点,特别是现在生物治疗制剂在治疗越来越多的癌症和其他危及生命的主要疾病方面的作用越来越大。
聚山梨酯是结构多样且(在某些情况下)具有化学活性物质的复合酯。PS-20和PS-80(吐温20和吐温80)分别是聚氧乙烯脱水山梨糖醇和月桂酸或油酸的结构相关脂肪酸酯的混合物。在PS-20中,单月桂酸酯部分包含40-60%的烷基链,不同链长的烷基构成分子的其余部分。在PS-80中,大约60%的烷基链来自油酸,其余的酯来自其他脂肪酸。所有市售的聚山梨酯还含有聚氧乙烯、脱水山梨糖醇聚氧乙烯和异山梨醇聚氧乙烯脂肪酸酯。
聚山梨酯经历内在自氧化产生反应性氢-和烷基-过氧化物,以及反应性醛类如甲醛和乙醛,其诱导可溶性蛋白的免疫原性。
聚山梨酯诱导的过敏反应
PS-80的过敏原特性越来越多地在临床文献中得到充分证明。由于聚山梨酯是一种表面活性剂,并且具有复杂的化学性质,确定聚山梨酯引起的过敏反应的确切机制很复杂。临床前动物研究已经确定了许多诱发过敏反应的特定分子种类。
早在1985年,科学家Masini等人证明聚山梨酯在外周组织和分离的肥大细胞中诱导组胺释放以及血液动力学反应。1997年,伯格等人报道,暴露于空气中的PS-80水溶液中会产生一定量的甲醛和乙醛,这可能会引起某些人的过敏反应。他们还首次预言性地警告药物开发人员要考虑在含有聚山梨酯和化学相似的表面活性剂的产品制造、储存和处理过程中形成的过敏性化合物的可能性。
库尔斯等人对PS-80作为严重过敏反应的诱导剂进行了深入的研究。他们补充了可接受的且灵敏的检测方法,包括皮肤点刺试验、酶联免疫吸附试验(ELISA)、免疫球蛋白E(IgE)免疫印迹,以及流式细胞仪检测对照患者和其他有以下病史的患者的嗜碱性粒细胞活化。由于怀孕期间静脉注射多种维生素产品(静脉注射药物的替代品)引起的过敏性休克。ELISA和免疫印迹均未鉴定出任何聚山梨酯特异性IgE抗体,证实了类过敏反应的非免疫学性质。该研究表明,PS-80可引起严重的非免疫类过敏反应。
还有人评估了来自不同生产批次的PS-80对狗的致敏效果,观察到了不同程度的过敏反应。同样,在评估来自不同供应商的10批PS-80溶液时,Yang等人发现自发形成的PS-80杂质,如过氧化物和氧化的脂肪酸残留物(在每个测试批次中以不同的水平存在)在体内模型中诱导过敏反应。
科学家还证明了聚山梨酯80会在狗中诱发典型的非免疫性过敏反应(假变态反应)——其特征是释放组胺和不变的IgE抗体。PS-80诱导组胺释放,SC5b-9(存在于血浆中的膜攻击复合物,在其浓度异常升高时,表现出细胞毒性)增加两倍,C4d增加2.5倍,Bb增加1.3倍,而IgE保持不变。PS-80引起狗的心肺窘迫,并通过经典和替代途径激活它们的补体系统,如体内和体外制剂所示。
随着越来越多的生物治疗制剂的重要性和常规使用越来越多,聚山梨酯引起的过敏反应的临床报告也越来越多。例如,两名接受奥马珠单抗治疗的患者在给药后发生反应。皮内测试对 PS-20产生了显着的风团和耀斑反应(荨麻疹和血管性水肿),这在阴性对照受试者中没有出现。体外和体内免疫学数据支持以下结论:两名患者在成功接受奥马珠单抗治疗一年多后出现的不良反应可能是类过敏性反应。一份关于无法解释的奥马珠单抗过敏反应的早期报告的作者没有考虑可能与药物中存在PS-20相关。
接受红细胞生长激素达贝生成素和促红细胞生成素的患者也出现了超敏反应。根据随后的皮肤测试和观察到的临床症状,研究人员得出结论,这些反应的原因是赋形剂PS-80。还有人认为,这可能导致了纯红细胞再生障碍的相关发病率。
在使用相同的术前用药方案比较含和不含PS-80的依托泊苷制剂的研究中,一名患者对含PS-80的制剂表现出超敏反应,但对不含PS-80的依托泊苷制剂则无过敏反应。所以得出结论,超敏反应可能是由于PS-80而不是依托泊苷本身。
有文献报告了多例PS-80诱导的过敏反应病例,这些病例由接种多种疫苗引起。一名17岁女孩在第三次肌肉注射含有PS-80的Gardasil四价人乳头瘤病毒疫苗(Merck)后一小时出现全身性荨麻疹、眼睑血管性水肿、鼻结膜炎、呼吸困难和喘息。该产品的皮内试验呈阳性,而二价疫苗(不含PS-80)的皮肤试验呈阴性。PS-80点刺试验在患者中呈阳性,在10名健康对照中呈阴性。CD203嗜碱性粒细胞活化测试结果在所有测试稀释度中对PS-80均为阴性,并且未发现特异性IgE。之后还对两种流感疫苗进行了皮肤测试:一种含有PS-80(葛兰素史克的Fluarix),结果呈阳性反应,另一种流感疫苗不含佐剂或防腐剂(赛诺菲巴斯德MSD的Vaxigrip)。
还有资料报道了一例对促红细胞生成素的过敏反应,患者出现全身性瘙痒、红斑和口面部血管性水肿。Eprex促红细胞生成素制剂(Johnson & Johnson)含有重组人促红细胞生成素和PS-80作为赋形剂(0.15mg/mL)。皮肤点刺和连续皮内测试,其浓度增加,Amgen的Neupogen非格司亭(含有0.04mg/mL的聚山梨酯)也显示出了阳性反应,而不含聚山梨酯的促红细胞生成素制剂是阴性的测试结果。用药用级聚山梨酯进行皮内测试,结果显示局部反应呈阳性,1小时后出现轻度口面部血管性水肿。在对照受试者中未观察到反应。当人白蛋白被聚山梨酯80和甘氨酸替代时,聚山梨醇酯80可能是导致促红细胞生成素免疫反应的原因。
已经报道了因子VIII、darbopoietin、促红细胞生成素和许多MAb药物的超敏反应和过敏反应,所有这些都含有表面活性剂聚山梨酯。已在英夫利昔单抗、阿达木单抗、依那西普和优特克单抗接受治疗的患者中发现了此类反应,它们都包含聚山梨酯80(4周单克隆抗体的药物)。此外,聚山梨酯诱导的过敏反应已经出现在那些含有聚山梨酯的非生物药中,例如维生素A,某些类固醇,以及抗病毒药物无环鸟苷。
从PS诱导的过敏反应中区分MAb诱导的过敏反应
尽管聚山梨酯可以而且确实会诱发过敏反应,但目前似乎没有临床试验试图区分聚山梨酯诱发的过敏反应和药物诱发的过敏反应。为此,必须进行单独的研究。过敏反应仅发生在一小部分患者中,所有这些患者的早期治疗对聚山梨酯的暴露史都不同。因此,选择多个对照组(之前没有接触过聚山梨酯和之前接触过不同时间段的对照组)进行研究试验是非常复杂和昂贵的,并且会进一步增加本已昂贵的临床测试和监管批准过程的成本。
预防
替代聚山梨酯的临床和商业计划是明确的。对于创新生物治疗药物,最大限度地减少过敏反应将为患者提供显着的临床和安全益处——可能会减少抗组胺药和类固醇预处理的时间和成本。目前有900多种生物仿制药和600多种 biobetter药物正在开发中,对高开发成本的担忧导致一些行业专家得出结论,生物仿制药的价格可能仅比相应的创新产品低20%。
这为医生证明将患者从具有良好特征的创新产品转向新推出的生物仿制药提供了一个障碍,而没有提供一些明确和实质性的临床益处。用表面活性剂替代聚山梨酯,最大限度地减少过敏反应发作,同时不允许进行性蛋白质降解或增加免疫原性,将满足关键需求,同时为所有相关人员提供显着差异化的临床益处:患者、医生和其他机构。
参考:
Bonamichi-Santos R, Castells M. Diagnoses and Management of Drug Hypersensitivity and Anaphylaxis in Cancer and Chronic Inflammatory Diseases: Reactions to Taxanes and Monoclonal Antibodies. Clin. Rev. Allergy Immunol. 2016; doi:10.1007/s12016-0168556-5.
Hawe A, et al. Fluorescent Molecular Rotors As Dyes to Characterize PolysorbateContaining IgG Formulations. Pharm Res. 27(2) 2010: 314–326; doi:10.1007/s11095-009-0020-2.
Maggio ET. Alkylsaccharides: Circumventing Oxidative Damage to Biotherapeutics Caused By Polyoxyethylene-Based Surfactants. Ther. Deliv. 4(5) 2013: 567–572.
Ha E, Wang W, Wang YJ. Peroxide Formation in Polysorbate 80 and Protein Stability. J. Pharm. Sci. 91(10) 2002: 2252–2264.
Kerwin BA. Polysorbates 20 and 80 Used in the Formulation of Protein Biotherapeutics: Structure and Degradation Pathways. J. Pharm. Sci. 97(8) 2008: 2924–2935; doi:10.1002/jps.21190.
Ayorinde FO, et al. Analysis of Some Commercial Polysorbate Formulations Using Matrix-Assisted Laser Desorption/Ionization Time-of-Flight Mass Spectrometry. Rapid Commun. Mass Spectrum. 14(22) 2000: 2116– 2124.
Brandner JD. The Composition of NF-Defined Emulsifiers: Sorbitan Monolaurate, Monopalmitate, Monostearate, Monooleate, Polysorbate 20, Polysorbate 40, Polysorbate 60, and Polysorbate 80. Drug Dev. Ind. Pharm. 24(11) 1998: 1049–054.
Frison-Norrie S, Sporns P. Investigating the Molecular Heterogeneity of Polysorbate Emulsifiers by MALDI-TOF MS. J. Agric. Food Chem. 49(7) 2001: 3335–3340.
Donbrow M, et al. Autoxidation of Polysorbates. J. Pharm. Sci. 67(12) 1978: 1676–1681.
Ha E, Wang W, Wang YJ. Peroxide Formation in Polysorbate 80 and Protein Stability. J. Pharm. Sci. 91(10) 2002: 2252–2264.
Wasylaschuk WR, et al. Evaluation of Hydroperoxides in Common Pharmaceutical Excipients. J. Pharm. Sci. 96(1) 2007: 106–116.
Kishore RSK, et al. Degradation of Polysorbates 20 and 80: Studies on Thermal Autoxidation and Hydrolysis. J. Pharm. Sci. 100(2) 2010: 721–731; doi:10.1002/jps.22290.
Lee JK, Vadas P. Anaphylaxis: Mechanisms and Management. Clin. Exp. Allergy 42(7) 2011: 923–938.
Khan BQ, Kemp FS. Pathophysiology of Anaphylaxis. Curr. Opin. Allergy Clin. Immunol. 11(4) 2011: 319–325; doi:10.1097/ACI.0b013e3283481ab6.
Simons FE. Anaphylaxis: Recent Advances in Assessment and Treatment. J. Allergy Clin. Immunol. 124(4) 2009: 625–636.
Oswalt ML, Kemp SF. Anaphylaxis: Office Management and Prevention. Immunol. Allergy Clin. North Am. 27(2) 2007: 177–191.
Brown SG et al. Anaphylaxis: Diagnosis and Management. Med. J. Australia 185(5) 2006: 283–289.
Simons, FE. World Allergy Organization Survey on Global Availability of Essentials for the Assessment and Management of Anaphylaxis By Allergy-Immunology Specialists in Health Care Settings. Ann. Allergy Asth. Immunol. 104(5) 2010: 405–412; doi:10.1016/j.anai.2010.01.023.
Akers MJ, DeFilippis MR. Peptide and Proteins As Parenteral Solutions. Pharmaceutical Formulation Development of Peptides and Proteins, Second Edition. Hovgaard, Frokjaer, van de Weert, Eds. CRC Press: Boca Raton, FL, 2013.
Kerwin BA. Polysorbates 20 and 80 Used in the Formulation of Protein Biotherapeutics: Structure and Degradation Pathways. J. Pharm. Sci. 97, 2008: 2924–2935; doi:10.1002/jps.21190.
Brandner JD. The Composition of NF-Defined Emulsifiers: Sorbitan Monolaurate, Monopalmitate, Monostearate, Monooleate, Polysorbate 20, Polysorbate 40, Polysorbate 60, and Polysorbate 80. Drug Dev. Ind. Pharm. 24(11) 1998: 1049–1054.
Frison-Norrie S, Sporns P. Investigating the Molecular Heterogeneity of Polysorbate Emulsifiers By MALDI-TOF MS. J. Agric. Food Chem. 49(7) 2001: 3335–3340.
Donbrow M, et al. Autoxidation of Polysorbates. J. Pharm. Sci. 67(12) 1978: 1676–1681.
Donbrow M, et al. Surface Tension and Cloud Point Changes of Polyoxyethylenic Nonionic Surfactants During Autoxidation. J. Pharm. Pharmacol. 27(3) 1975: 160–166.
Donbrow M, et al. Development of Acidity in Nonionic Surfactants: Formic and Acetic Acid. Analyst(London) 103(1225) 1978: 400–402.
Ha E. Peroxide Formation in Polysorbate 80 and Protein Stability. J. Pharm. Sci. 91(10) 2002: 2252–2264.
Wasylaschuk WR, et al. Evaluation of Hydroperoxides in Common Pharmaceutical Excipients. J. Pharm. Sci. 96(1) 2007: 106–116.
Liu JY, et al. Measurement of the Peroxidation of Brji-35 in Aqueous Solution By Hemin and Horseradish Peroxidase Catalyzed Fluorogenic Reaction. Fresenius J. Analyt. Chem. 365(5) 1999: 448–451.
Erlandsson B. Stability-Indicating Changes in Poloxamers: The Degradation of Ethylene Oxide-Propylene Oxide Block Copolymers at 25 and 40 °C. Polym. Degrad. Stabil. 78(3) 2002: 571–575.
Masini E, et al. Histamine-Releasing Properties of Polysorbate 80 In Vitro and In Vivo: Correlation with Its Hypotensive Action in the Dog. Agents Actions 16(6) 1985: 470–477.
Bergh M, et al. Contact Allergenic Activity of Tween 80 Before and After Air Exposure. Contact Dermat. 37(1) 1997: 9–18.
Coors E, et al. Polysorbate 80 in Medical Products and Nonimmunologic Anaphylactoid Reactions. Ann. Allergy Asthma Immunol. 95(6) 2005: 593–539.
Sun W, et al. Anaphylactoid Reactions Induced By Polysorbate 80 on Beagle Dogs. Zhongguo Zhong Yao Za Zhi 36(14) 2011: 1874– 1878.
Yang R, et al. Tween-80 and Impurity Induce Anaphylactoid Reaction in Zebrafish. J. Appl. Toxicol. 35(3) 2015: 295–301; doi:10.1002/jat.3069.
Qiu S, et al. Complement Activation Associated with Polysorbate 80 in Beagle Dogs. Int. Immunopharmacol. 15(1) 2013: 144–149; doi:10.1016/j.intimp.2012.10.021.
Price KS, Hamilton RG. Anaphylactoid Reactions in Two Patients After Omalizumab Administration After Successful Long-Term Therapy. Allergy Asthma Proc. 28(3) 2007: 313–319.
