朱耀教授 遗传相关前列腺癌的精准诊治进展
编者按
前列腺癌存在“乌龟、兔子、老鹰”等三种不同进展速度的状态,携带BRCA2胚系突变的前列腺癌往往预后较差,是不折不扣的“鹰派”角色。如何深入挖掘此类患者的生物学特征,并制定精准的筛查和诊治策略,是目前临床研究和实践需要解决的问题。复旦大学附属肿瘤医院朱耀教授与我们分享了两项在2020年ESMO大会上报道的最新研究,或将对临床有所启发。

长期从事泌尿男生殖系统肿瘤的临床诊治工作,主攻前列腺癌根治术和综合治疗。2019年复旦大学青年五四奖章、上海市卫健委青年五四奖章获得者。入选2018年上海市“医苑新星”杰出青年医学人才,入选第七届复旦大学十大医务青年,入选第三批复旦大学卓学人才计划,入选2015年上海市青年科技启明星计划。担任Prostate Cancer and Prostatic Disease编委,以通讯作者在European Urology和Journal of Urology等SCI期刊发表8篇论文,以第二完成人获得上海市科技进步奖一等奖。
PROREPAIR研究:体细胞改变对携带gBRCA2前列腺癌患者的影响(摘要号:612MO)
胚系BRCA2突变(gBRCA2)与前列腺癌的不良临床结局相关,然而,这种临床侵袭性的分子起源尚未完全阐明。
在这项多中心病例对照研究中,根据Gleason评分和诊断分期(M0 vs M1)将gBRCA2携带者与非携带者按照1:2的比例进行匹配。至少需要60个病例(120个对照病例)来证明5年病因特异性生存率(CSS)为60% vs 85%。研究的主要目的是确认gBRCA2在前列腺癌CSS中的孤立预后作用。次要目的包括通过FISH探讨BRCA2、RB1、MYC、PTEN和TMPRSS2-ERG中躯体事件的临床影响。Kaplan-Meier和Cox回归模型用于确定分子特征与预后之间的关联。
研究共入组了73例gBRCA2携带者和127例非携带者符合条件。gBRCA2携带者诊断时较年轻(P=0.02),T3/4期的发生率高于非携带者(p<0.001),但未发现其他显著差异。gBRCA2携带者的体细胞改变多于非携带者(P<0.001),包括BRCA2缺失、RB1缺失和MYC扩增、RB1共缺失(Pearson相关系数0.96;P=0.001)。
gBRCA2突变与CSS孤立相关(HR 3.70;P=0.008)。存在体细胞BRCA2-RB1编码或MYC扩增的gBRCA2携带者,其CSS相较于不存在此类改变的gBRCA2携带者更短。在非gBRCA2携带者中观察到类似的结果(表)。MVA模型证实了体系BRCA2-RB1编码(HR=4.13;P=0.004)和MYC扩增(HR=2.27;P=0.033)对CSS的孤立预后价值。
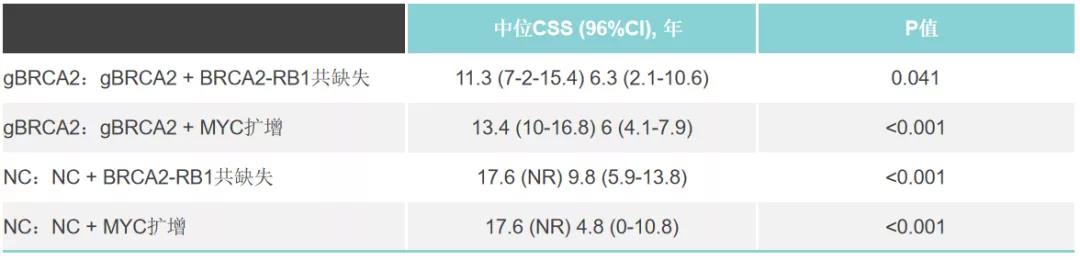
PROREPAIR-A是迄今为止最大的gBRCA2肿瘤研究,旨在探索体系改变与前列腺癌临床结局之间的关系。该研究结果表明,体系BRCA2-RB1缺失和MYC扩增定义了一种侵袭性前列腺癌亚型,gBRCA2携带和非携带者的临床结局均较差。
BRCA携带者的前列腺癌初筛策略:PSA+mpMRI(摘要号:LBA22)
BRCA1/2基因突变的男性携带者患前列腺癌的风险更高,其表型更具侵略性。目前的筛查指南建议仅在BRCA2携带者中使用PSA。该研究探讨在此基础上联合多参数磁共振成像(mpMRI)来检测BRCA携带者的前列腺癌患病率。
研究入组了40-70岁的男性,且携带BRCA1/2胚系突变,没有前列腺活检史。所有男性都接受包括PSA和前列腺mpMRI筛查。PSA的年龄分层阈值为:40-50岁≥1ng/mL;50-60岁≥2ng/mL;60-70岁≥2.5ng/mL;PSA升高和/或mpMRI可疑病变的男性进行前列腺活检。评估PSA水平、MRI表现、前列腺癌发生率和肿瘤特征。
共有188名男性(108例为BRCA1,80例为BRCA2)入组,平均年龄54岁(±9.8)。110例(57%)患者筛查异常,包括PSA升高75例(40%),MRI可疑病变67例(6%),两者均异常32例(17%)。其中92例(85%)同意接受活检。16例(8.5%)被诊断为前列腺癌;44%的肿瘤为中危或高危。
基于mpMRI的筛查只漏掉了一例前列腺癌(6%),而年龄分层的PSA则漏掉了5例(31%)。决策曲线分析显示,无论PSA如何,mpMRI筛查对PCa诊断的净效益最高,尤其是在55岁以下的男性中。研究发现BRCA1和BRCA2的前列腺癌风险没有差异(8.3% vs 8.7%,P=0.91)。
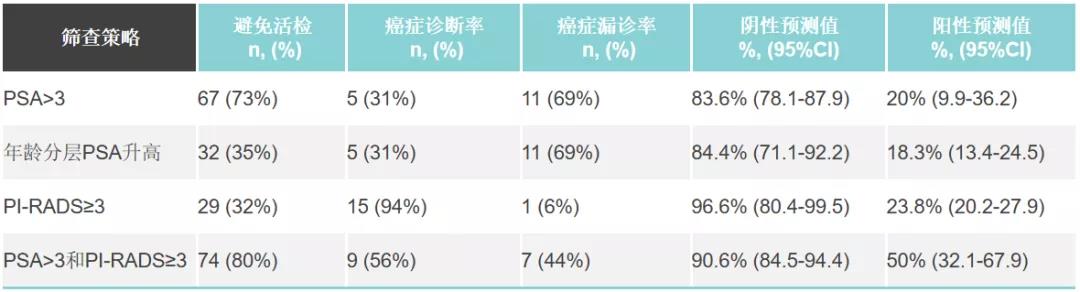
该研究表明前列腺癌在BRCA携带者中普遍存在。年龄可能影响该人群的前列腺癌筛查策略。年轻的携带者可以从最初的MRI筛查中获益。年龄大于55岁的BRCA携带者如果PSA升高需联合mpMRI检查。
朱耀教授点评
ESMO20的两篇摘要报道了遗传相关前列腺癌的诊治进展。612MO基于PROREPAIR-A研究分析了胚系BRCA1/2突变前列腺癌患者的预后相关因素,结果证实RB1缺失或MYC扩增是遗传性前列腺癌预后不良的关键因素,死亡风险增加2~4倍。LBA22报道了胚系BRCA1/2突变携带者进行前列腺癌早筛的初步数据,结果显示依赖于PSA诊断遗传性前列腺癌的漏诊率高达69%,而通过MRI可以将漏诊率降低至6%,提示精准影像学是遗传性前列腺癌早诊的关键。
这两项研究进一步填补了遗传相关前列腺癌的诊治空白。我们都非常熟悉前列腺癌存在“乌龟、兔子、老鹰”三种状态,而胚系BRCA1/2突变前列腺癌可以说是“老鹰”的代表类型。目前针对这一类高度恶性前列腺癌仍然存在许多诊治争议,其中最关键的是:目前的诊治手段是否合适?如果不合适,哪些需要改变?
612MO研究证实存在RB1缺失或MYC扩增的遗传性前列腺癌预后更差,这是应当及早提供新的治疗手段的目标人群。由于PROREPAIR-A研究并未采用针对性的靶向治疗(如PARPi或铂类),因此这个研究提示了“老鹰中的战斗机”,需要我们更快的对这类高度恶性患者采取及早的干预,开展相应的临床试验,看看能否逆转此类患者的预后。
LBA22研究则是证实了基于PSA的常规筛查方式不能用于胚系BRCA1/2突变前列腺癌的早筛,即使作者采用了非常严苛的PSA早诊标准,即40-50岁PSA≥1ng/mL,50-60岁PSA≥2ng/mL,60-70岁PSA≥2.5ng/mL,前列腺癌的漏诊率仍然极高。好在通过MRI的PIRADS评分≥3,可以将漏诊率降低至6%。值得注意的是,即使如此,仍有44%的遗传性前列腺癌初诊就是中高危,这和常规人群PSA筛查后20%是中高危相比,增加了一倍。提示了遗传性前列腺癌的“本性之恶”,需要及早的干预。
虽然ESMO20关注了遗传相关前列腺癌的诊治进展,但数据量的不足以及缺乏突破性的诊治手段仍然限制了我们根本性地扭转这些“恶中之恶”前列腺癌的不良预后。后续更多的研究需要在治疗反应预测、联合治疗方案和预防癌变等方面展开。
参考资料:
[1]612MO - Clinical impact of somatic alterations in prostate cancer patients with and without previously known germline BRCA1/2 mutations: Results from PROREPAIR-A study. Presented at ESMO2020.
[2]LBA22 - Imaging based PCa screening among BRCA mutation carriers: Results from the first round of screening. Presented at ESMO2020.
