2020 ESMO年会神经内分泌肿瘤药物临床试验分享
2020 ESMO年会神经内分泌肿瘤
药物临床试验分享
受新冠影响,一年一度的欧洲肿瘤内科学会年会(ESMO)于9月下旬线上举办。作为一个小瘤种,神经内分泌肿瘤在ESMO年会上依然只是一个很不起眼的小角色,只有十多篇大会摘要和8个口头报告(包括小口头报告)。但是今年年会上公布了神经内分泌肿瘤领域几个很受业内关注的II期和III期药物临床试验结果,还是值得跟大家分享一下。
CLARINET FORTE 研究
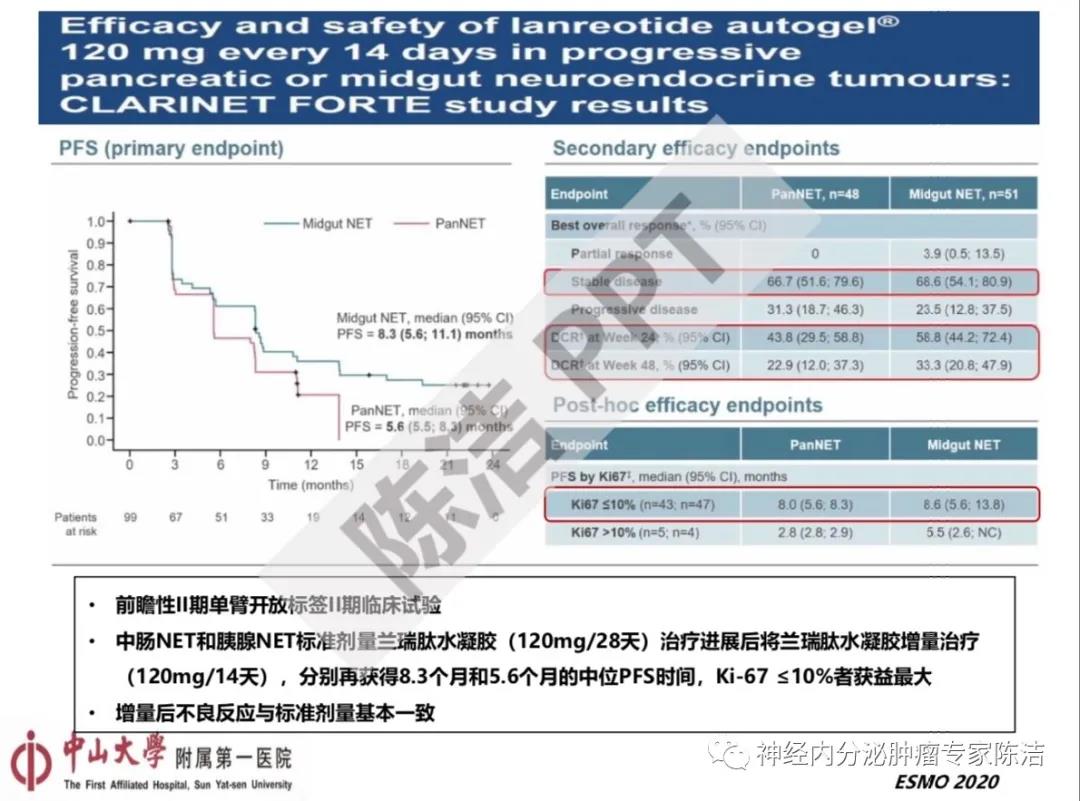
第一个是关于SSA增量治疗的CLARINET FORTE 研究。虽然SSA增量治疗已经被各大NET诊治指南所推荐,但其临床证据主要来自回顾性临床研究,以及NETTER-1研究。NETTER-1研究是探讨PRRT+长效奥曲肽30mg对照长效奥曲肽60mg对转移性中肠神经内分泌肿瘤疗效的前瞻性III期随机对照临床试验,主要旨在验证PRRT的疗效,但其也间接证明了30mg长效奥曲肽治疗进展后的中肠NET,使用60mg长效奥曲肽后又可以额外获得8.4个月的中位PFS时间。CLARINET FORTE 研究是首个专门探讨SSA增量治疗的前瞻性II期临床试验,其结果表明中肠和胰腺NET在标准剂量兰瑞肽水凝胶治疗进展后将兰瑞肽水凝胶增量(缩短治疗间期),可以分别再获得8.3个月和5.6个月的中位PFS时间,Ki-67 ≤10%者获益最大,这个结果和NETTER-1研究比较类似。因此临床上无论长效奥曲肽和兰瑞肽水凝胶都可以采用增量治疗这个策略,使其疗效最大化。
REMINET研究
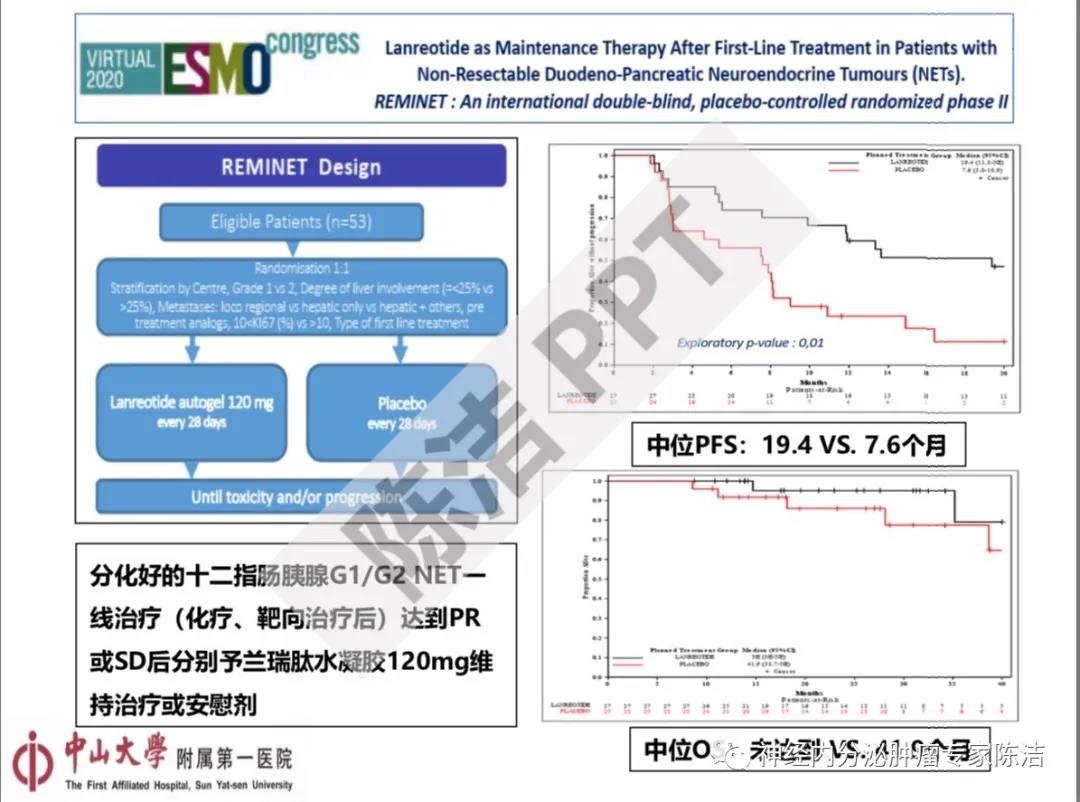
第二个是关于SSA维持治疗的REMINET研究。这是一个国际多中心双盲随机对照II期临床试验,旨在探讨分化好的十二指肠胰腺G1/G2 NET一线治疗(化疗、靶向治疗)达到PR或SD后分别予兰瑞肽水凝胶120mg维持治疗或安慰剂的效果。结果表明和安慰剂对照组比较,兰瑞肽水凝胶120mg/28天维持治疗可以显著延长患者的中位PFS和OS。这个研究的临床意义在于针对化疗或者靶向治疗这类药物毒性相对较高的治疗,可以在达到稳定疗效后采用SSA这类不良反应较低的药物进行后续维持治疗,这一策略可能使患者获得较好的临床疗效而降低整体药物不良反应。
ATLANT研究
第三个是SSA联合化疗治疗胸部分化好的神经内分泌肿瘤的ATLANT研究。胸部分化好的神经内分泌肿瘤,包括支气管肺或胸腺类癌及非典型类癌,前瞻性临床研究非常少,治疗上临床常常参考胃肠胰神经内分泌肿瘤的模式。但是胸部神经内分泌肿瘤有其独特的生物学行为,以及和胃肠胰神经内分泌肿瘤不同的临床病理特点,例如容易发生骨转移而不是肝转移,生长抑素受体常常低表达或者不表达。ATLANT研究是一个小样本前瞻性单臂II期临床试验,探讨兰瑞肽水凝胶联合替莫唑胺治疗不可切除、局部进展或者转移性胸部分化好的神经内分泌肿瘤(支气管肺或胸腺类癌及非典型类癌)的效果。结果:9个月时的疾病控制率(DCR=SD+PR+CR)为35%,中位PFS 37.1周。和胃肠胰神经内分泌肿瘤相比,这个效果只能算做一般。

SANET-p研究
第四个是今年ESMO年会上公布的神经内分泌肿瘤最重磅,也是唯一的一个III期临床试验:SANET-p。SANET-p是中国自主研发的TKI类抗血管生成靶向药物索凡替尼治疗胰腺神经内分泌肿瘤的III期临床试验。去年的ESMO年会公布了索凡替尼在非胰腺神经内分泌肿瘤里的III期临床试验(SANET-ep)结果,SANET-p的结果让大家翘首等待了一年,效果依然是预料之中的好,和安慰剂相比,索凡替尼治疗晚期胰腺NET(G1/G2级)的中位PFS为13.9个月(安慰剂组4.6个月),客观有效率索凡替尼组为14%(安慰剂组2%)。无论从中位PFS还是从客观有效率来看,索凡替尼都超越了之前的同类靶向药物舒尼替尼的III期临床试验结果。在ESMO年会SANET-p结果公布的同一天,SANET-ep和SANET-p试验同期在线发表于肿瘤学的顶级期刊Lancet Oncol,这是神经内分泌肿瘤药物治疗领域的中国之光,索凡替尼也成为第一个同时覆盖胰腺和非胰腺G1/G2级神经内分泌肿瘤的TKI类抗血管生成靶向药物。

RESUNET研究
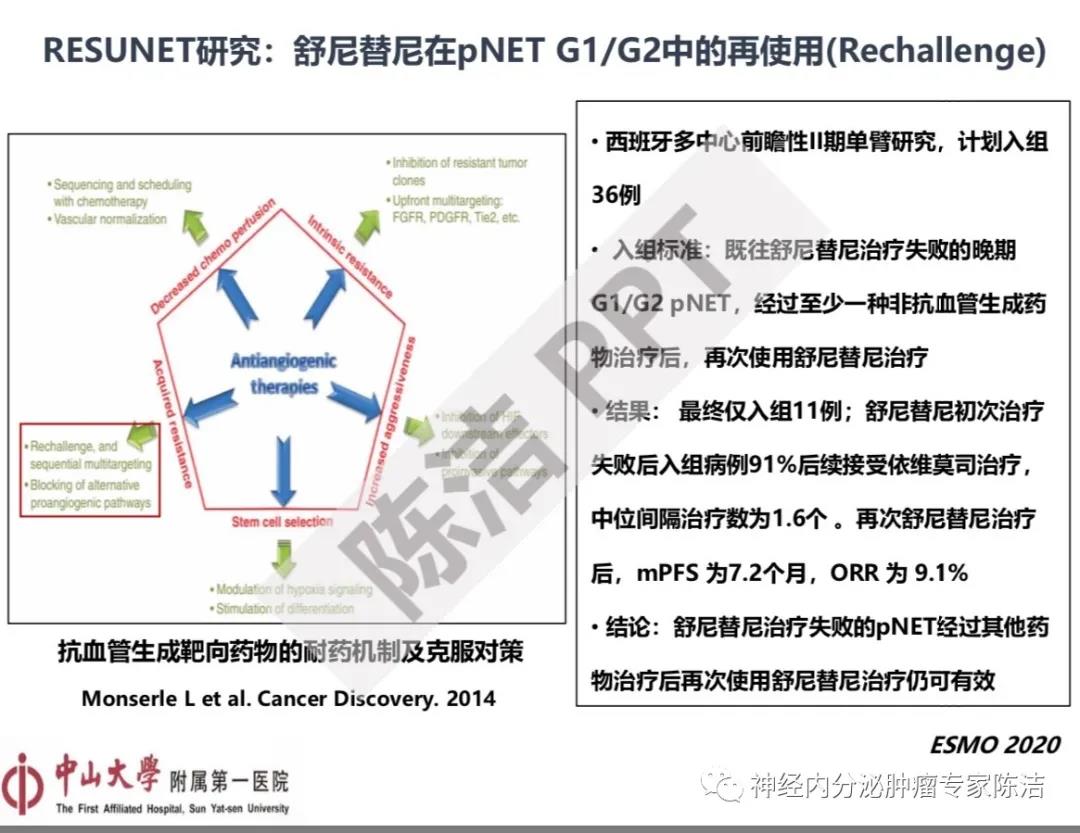
第五个是舒尼替尼在胰腺神经内分泌肿瘤中再使用(Rechallenge)的RESUNET研究。这个研究设计的主要目的是探讨能否通过Rechallenge的方式来克服抗血管生成靶向药物的获得性耐药。这是一个西班牙多中心前瞻性II期单臂研究,计划入组36例,最终只入组了11例,因为入组缓慢试验不得不终止。入组标准为既往舒尼替尼治疗失败的晚期G1/G2 pNET,经过至少一种非抗血管生成药物治疗后,再次使用舒尼替尼治疗。结果:舒尼替尼初次治疗失败后入组病例91%后续接受依维莫司治疗,中位间隔治疗数为1.6个。再次使用舒尼替尼治疗后,mPFS 为7.2个月,ORR 为 9.1%。虽然这个研究只有11例入组的数据,依然可以看出“Rechallenge”可以作为一种克服抗血管生成靶向药物获得性耐药的治疗策略。
DUNE研究
第六个是PD-L1和CTLA-4单抗双免疫检查点抑制剂联合治疗神经内分泌肿瘤的DUNE研究。神经内分泌肿瘤总体而言属于免疫冷肿瘤,即PD-L1表达低、肿瘤突变负荷低、微卫星稳定、以及肿瘤组织内免疫淋巴细胞浸润很少。以PD-1单抗为代表的免疫检查点抑制剂单药疗效极为有限(客观有效率ORR低于5%),因此目前临床试验集中于联合治疗,包括双免疫检查点抑制剂联合,免疫检查点抑制剂联合化疗、抗血管生成靶向治疗等。双免疫检查点抑制剂联合治疗之前已经有CTLA-4抑制剂伊匹木单抗联合PD-1抑制剂纳武利尤单抗的DART SWOG 1609II期临床试验,其在非胰腺神经内分泌肿瘤队列的结果已经发表。今年ESMO年会上公布了第二个双免疫检查点抑制剂联合治疗DUNE研究的结果。这是一个前瞻性II期研究,包括4个队列:肺类癌/不典型类癌,G1/G2 GI-NETs,G1/G2 Pan-NETs,G3 GEP-NENs。标准治疗失败后接受PD-L1单抗durvalumab+CTLA-4单抗tremelimumab联合治疗。结果:N=123,9个月时的临床获益率(CR+PR+SD):肺NET 7.4%, GI-NETs 32.3%,Pan-NETs 25%;G3 GEP-NENs 9个月时的OS 36.1%。irORR:肺NET 7.4%, GI-NETs 0%,Pan-NETs 6.3%,G3 GEP-NENs 9.1%;肺和胰腺队列的irORR与PD-L1的表达相关。中位PFS:肺NET 5.3月,GI-NETs 8.0月,Pan-NETs 8.1月,G3 GEP-NENs 2.5月。结论:PD-L1和CTLA-4单抗双免疫检查点抑制剂联合治疗对神经内分泌肿瘤疗效依然很有限;客观有效率较低。

