当CAR-T序贯造血干细胞移植,是否能为B-ALL带来疗效新突破?
CD19嵌合抗原受体(CAR)T细胞(CD19 CAR-T)疗法在B细胞急性淋巴细胞白血病(B-ALL)中表现出令人瞩目的早期缓解率,但其治疗的长期随访数据尚缺乏。本文展示了迄今为止报道的B-ALL患者经CD19 CAR-T细胞治疗后的最长随访数据,并证实CD19.28ξ CAR-T细胞序贯异基因造血干细胞移植(allo-HSCT)巩固治疗可在相当一部分复发或难治性B-ALL患者中提供持续的疾病控制。
背景
CD19-CAR T细胞疗法在儿童及年轻成人(CAYA)B-ALL患者中具有高应答率,但治疗后复发率也高。Tisagenlecleucel(全球首个CAR-T细胞疗法)治疗CAYA复发或难治性B-ALL患者的全球性Ⅱ期试验显示,输注后28天的完全缓解(CR)率高达82%;但其有限的随访数据(中位随访13.1个月)表明,仅59%的患者处于持续缓解中,大部分复发为CD19阴性疾病。
Allo-HSCT能够改善化疗缓解后复发或难治性B-ALL患者的长期无病生存,但allo-HSCT巩固治疗在经CD19 CAR-T治疗后患者中的作用仍未知,临床实践也尚未统一。
本文报告了50例接受自体移植CD19.28ξ CAR-T细胞治疗B-ALL患者的长期预后结果。此外,相当一部分患者在CD19 CAR-T细胞治疗后接受了allo-HSCT,为评估CD19 CAR-T后allo-HSCT在CAYA中的作用提供了机会。
方法
这是一项自体移植CD19.28ξ CAR-T细胞治疗3~30岁复发或难治性B-ALL患者的单中心研究(NCT01593696),Ⅰ期剂量递增阶段纳入20例患者,扩展期额外纳入30例患者。通过中位随访4.8年,评估患者的治疗反应和长期临床结局,以及疾病和治疗变量的关系。通过描述性统计总结患者和疾病的特征;采用Kaplan-Meier曲线显示B-ALL患者的无事件生存(EFS)和总生存(OS)情况。
结果
患者特征
表1. B-ALL患者的人口学特征和疾病特征
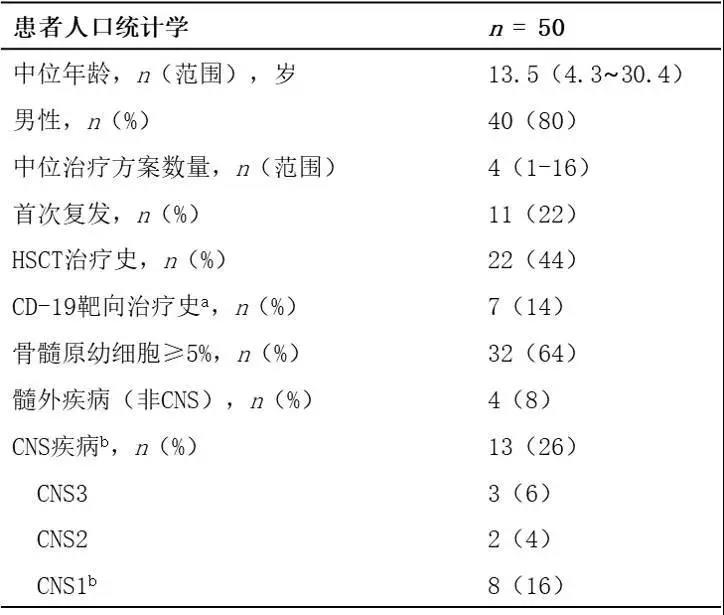
注:aa2例患者有CD19 CAR-T细胞治疗史,5例有博纳吐单抗(Blinatumomab)治疗史;b包括流式细胞疾病检测。CNS:中枢神经系统;CNS3:脑脊液(CSF)中白细胞(WBC)>5/μL且原幼细胞cytospin阳性;CNS1:CSF中未见cytospin阳性的原幼细胞,无论WBC数量;CNS2:脑脊液(CSF)中白细胞(WBC)<5/μL且原幼细胞cytospin阳性。
毒性
35例(70.0%)患者出现细胞因子释放综合征(CRS),其中9例(18.0%)等级达到3~4级(表2);并且,CRS严重程度与疾病负担相关,疾病负担越重(骨髓象≥M2)的患者发生3~4级CRS的可能性越高(P=0.005)。
表2. CAR-T细胞治疗B-ALL患者的毒性反应
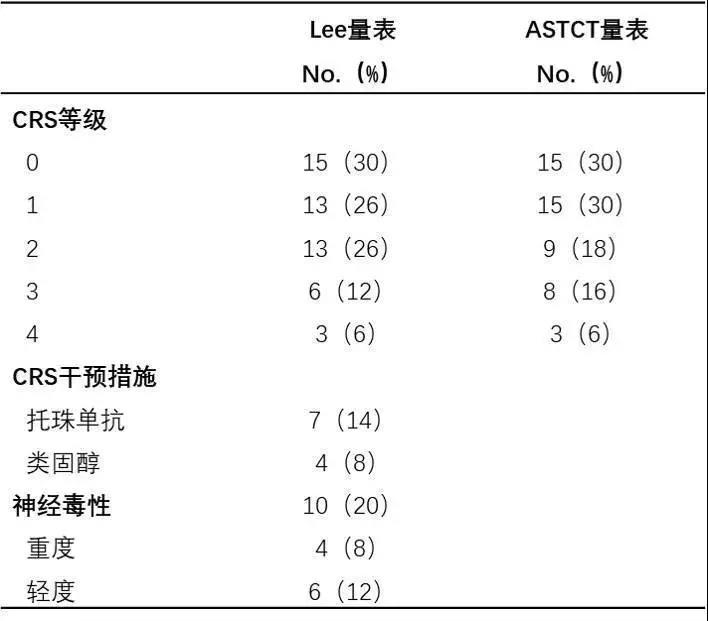
注:ASTCT:美国移植及细胞治疗协会;CRS:细胞因子释放综合征。
疗效
在接受治疗的50例B-ALL患者中,31例(62.0%)达到了CR,其中28例(56.0%)为微小残留病灶(MRD)阴性的CR。首次复发(P=0.0035),既往接受的治疗方案更少(P=0.033),M1型骨髓象(MRD阳性,原幼细胞<5%)(P=0.0007),或接受Flu/Cy淋巴细胞耗竭治疗(P=0.041)的患者CR率更高(图1)。缓解持续时间图2所示,且受allo-HSCT治疗的影响。大部分患者中,CAR-T细胞能够穿过血脑屏障。
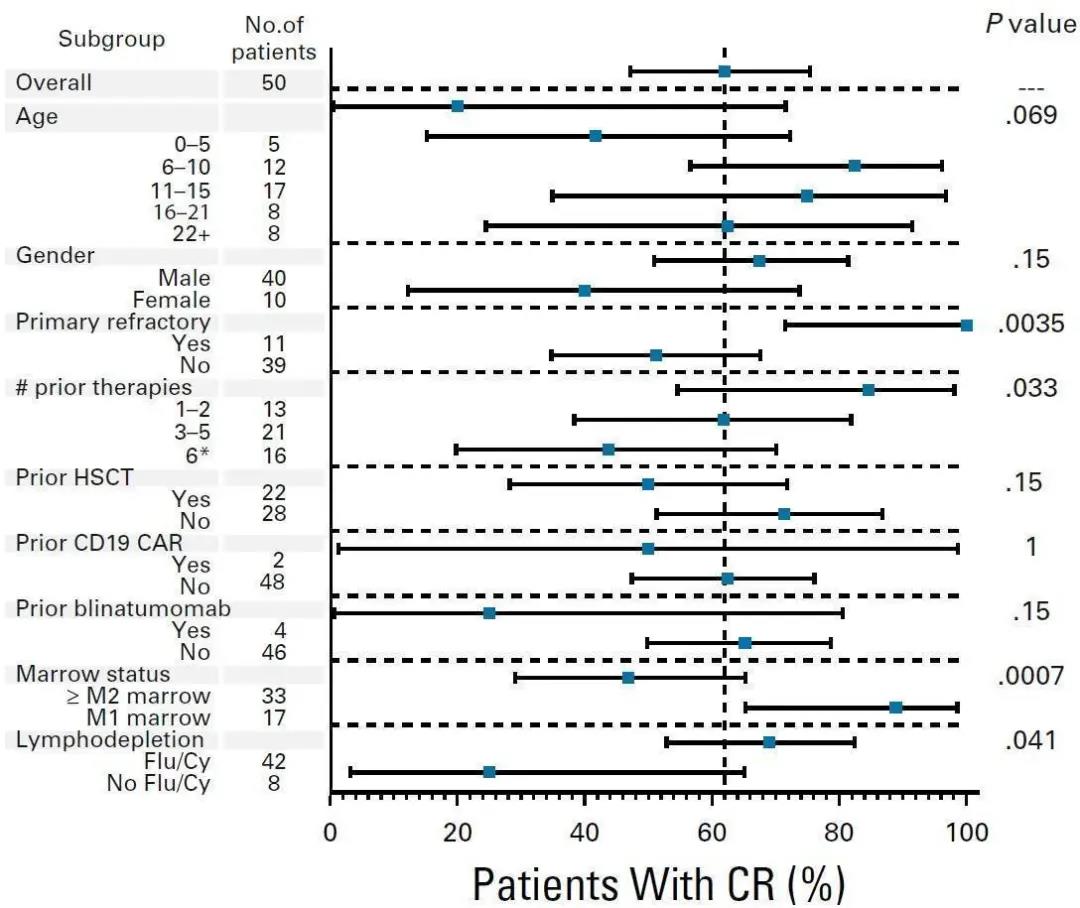
图1. 根据人口统计学、疾病特征和治疗过程分层的CR患者比例。方块表示观察到的CR率,线条表示95%CI。
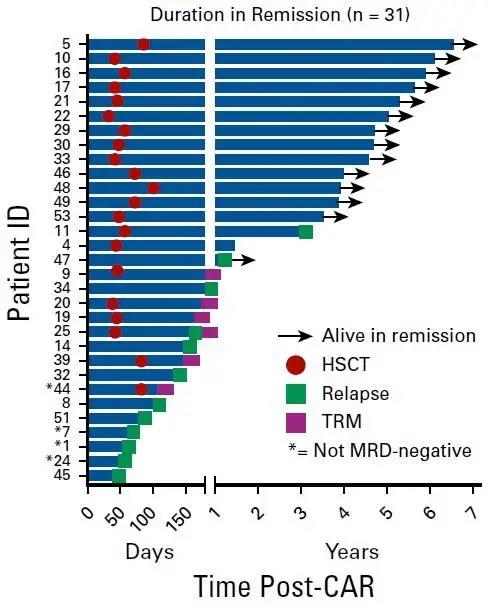
图2. 达到CR的患者持续缓解的时间
CAR-T细胞扩散与细胞因子水平
CR与更高的CAR-T细胞扩散率和3~4级CRS有关(图3)。缓解率与输注CAR-T细胞上的T细胞耗竭标志物PD1、TIM 3或LAG3均无显著相关性。
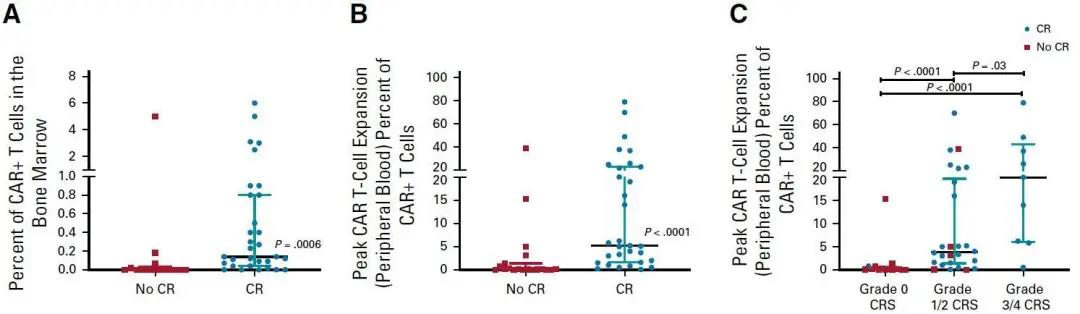
图3. A:治疗28天后CAR-T细胞在骨髓内的中位扩散率及四分位间距,患者根据是否达到完全缓解分层;B:治疗28天后CAR-T细胞在外周血中峰扩散率(T细胞中呈CAR-T细胞阳性的比例)的中位值及四分位间距,患者根据是否达到完全缓解分层;C:治疗28天后CAR-T细胞在外周血中峰扩散率(T细胞中呈CAR-T细胞阳性的比例)的中位值及四分位间距,患者根据CRS的等级分层。
长期结局
中位随访4.8年(范围, 3.5~7.2年)后,全队列的中位OS为10.5个月(95%CI, 6.3~29.2个月),中位EFS为3.1个月(95%CI, 0.9~7.7个月);3个月EFS为52.0%(95%CI, 37.4~64.7),6个月EFS为38%(95%CI, 24.8~51.1)(图4)。Flu/Cy治疗能够改善EFS和OS。疾病负担较轻的患者尚未达到中位EFS,疾病负担较重的患者中位EFS为0.9个月(95%CI, 0.9~2.0个月)(P≤0.0001)。
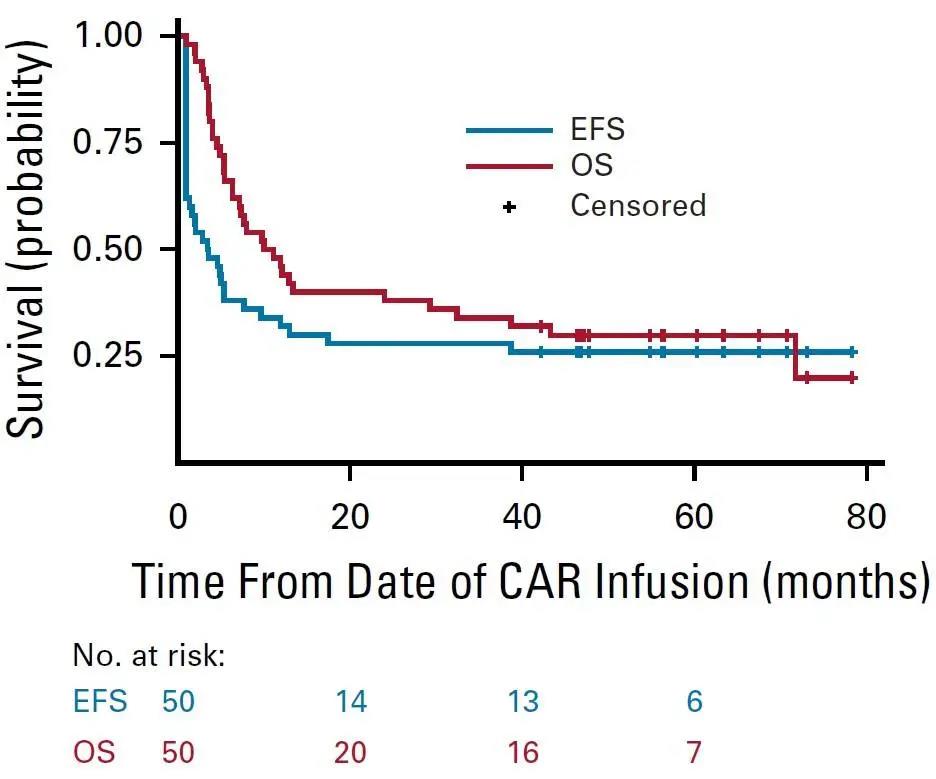
图4. CAR-T细胞输注后B细胞-急性淋巴细胞白血病患者的OS和EFS
HSCT巩固治疗的作用
28例达到MRD阴性CR的患者中,21例(75%)接受了巩固性allo-HSCT治疗。HSCT治疗后中位OS为70.2个月(95%CI, 10.4~无法估算),中位EFS未达到;allo-HSCT治疗后5年EFS为61.9&(95%CI, 38.1~78.8)(图5)。Allo-HSCT治疗后12个月和24个月的累积复发率分别4.8%(95%CI, 0.3~20.3)和9.5%(95%CI, 1.5~26.8);而7例未接受巩固性HSCT治疗的MRD-阴性CR患者在CAR-T细胞输注后复发的中位时间为152天(范围, 94~394天),表明了allo-HSCT巩固治疗的重要性。
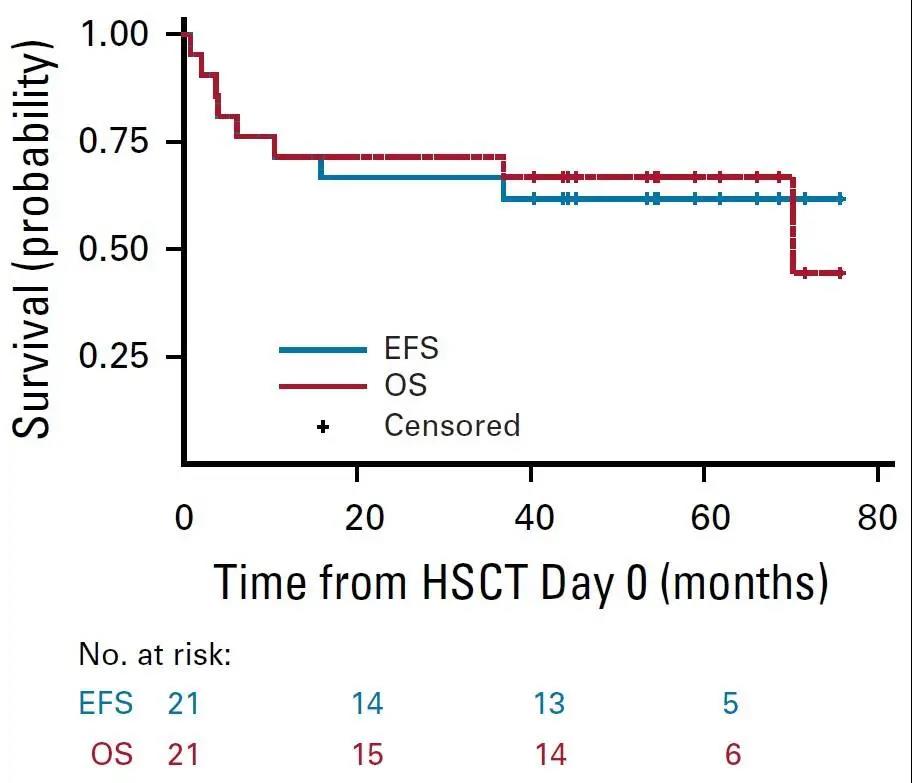
图5. Allo-HSCT治疗后的OS及EFS
结论
综上可得,CD19.28ξ CAR-T细胞疗法序贯巩固性allo-HSCT治疗能够使CAYA人群中的复发或难治性B-ALL患者得到长期持续的疾病控制。Allo-HSCT治疗后可观察到显著延长的、具有明显平台期和低复发率的EFS,为这一序贯治疗方案的长期疗效提供了支持。
参考文献
Shah NN, Lee DW, Yates B, et al. Long-Term Follow-Up of CD19-CAR T-Cell Therapy in Children and Young Adults With B-ALL. J Clin Oncol. 2021 Mar 25:JCO2002262. doi: 10.1200/JCO.20.02262.
