那些肿瘤完全消失的“超级响应者”, 都有些什么特征?
癌症难治,但也有奇迹。有一小部分晚期癌症患者,在接受治疗时疗效特别好,远超预期,生存期也明显长于类似的患者。他们被叫做“超级响应者”。
这些超级响应者,到底有什么特殊的地方?是什么让他们的治疗效果如此之好?
近日,美国国家癌症研究所的Louis M. Staudt就分析了111名超级响应者的特征,找出了其中大约1/4患者治疗效果极好的可能原因[1]。这些原因大致分为四个方面:DNA损伤修复、信号通路、免疫因素和预后基因。接下来,我们就来看看这些超级响应者是怎么回事。
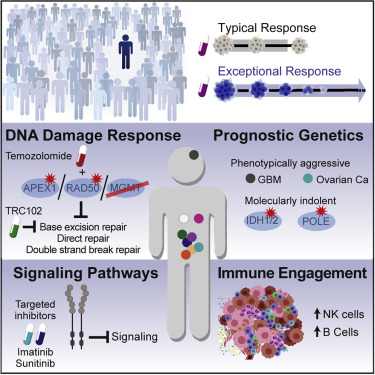
一、肿瘤的DNA损伤修复缺陷
第一位超级响应者是一位多形性胶质母细胞瘤患者,先后接受过手术切除、局部的卡莫司汀化疗和放疗,复发后又使用替莫唑胺,保持了10年以上的完全缓解。
第二位超级响应者患有的是转移性结肠腺癌,Ta在一次临床试验中接受了替莫唑胺联合试验药物TRC102的治疗,获得了至少45个月的近似完全缓解。
替莫唑胺是一种烷化剂,通过对DNA的烷基化造成肿瘤细胞DNA损伤而死亡。对于替莫唑胺造成的DNA损伤,肿瘤细胞可以通过两种方法去修复——直接修复和碱基切除修复。
研究发现,这两位超级响应者的肿瘤细胞,DNA的直接修复和碱基切除修复都存在缺陷,难以修复化疗造成的损伤。这可能正是他们获得极好疗效的原因。
另外,在替莫唑胺联合TRC102的试验中,还有一人DNA的直接修复途径存在缺陷,碱基切除修复正常,ta对治疗部分相应。而其余10位两种DNA修复途径都正常的患者则治疗无效。
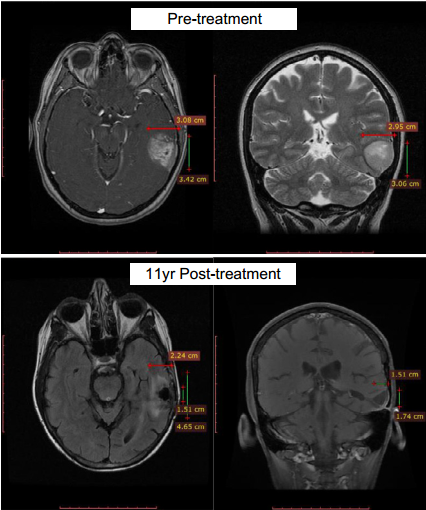
治疗11年后仍完全缓解
铂类药物是另一类使用很广的化疗药,通过交联作用损伤DNA,需要同源重组修复。8例使用铂类药物的超级响应者中,有6例的肿瘤都存在BRCA1、BRCA2或PALB2的突变。
比如第三位超级响应者,一位HER2阳性的转移性乳腺癌患者,使用曲妥珠单抗、卡铂和多烯紫杉醇联合治疗后完全缓解持续7年。
该患者肿瘤中BRCA1完全缺失,BRCA2和BRIP1突变失活。这三个蛋白共同负责DNA的同源重组修复。正是这三个基因的缺陷,使该患者的肿瘤对铂类药物十分敏感。
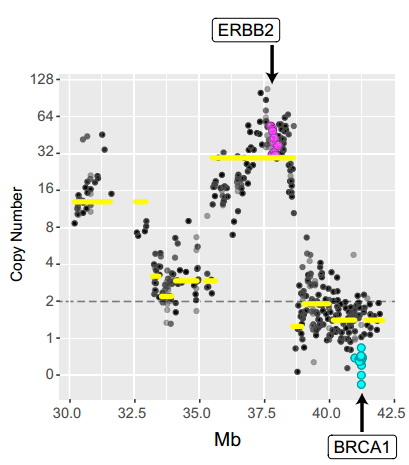
患者肿瘤BRCA1完全丢失
二、肿瘤信号通路
第四位超级响应者是一位雌激素受体(ER)阳性的乳腺癌患者。她的肿瘤同时还有高水平的HER2基因扩增,所以使用了曲妥珠单抗联合阿那曲唑治疗,获得了2.4年的持续部分响应。
这个患者,HER2基因虽然高度扩增,但HER2的mRNA水平很低,引起她超级响应的应当是阿那曲唑。
阿那曲唑是一种芳香化酶CYP19A1的抑制剂,这个酶在人体内催化睾酮转化为雌二醇的过程,是合成雌激素的一个关键酶。这位患者的CYP19A1表达恰好十分的高,放在美国癌症基因组图谱中能排到前1.5%,她的肿瘤可能极为依赖CYP19A1所产生的雌激素信号。这应当就是她治疗效果极佳的原因。
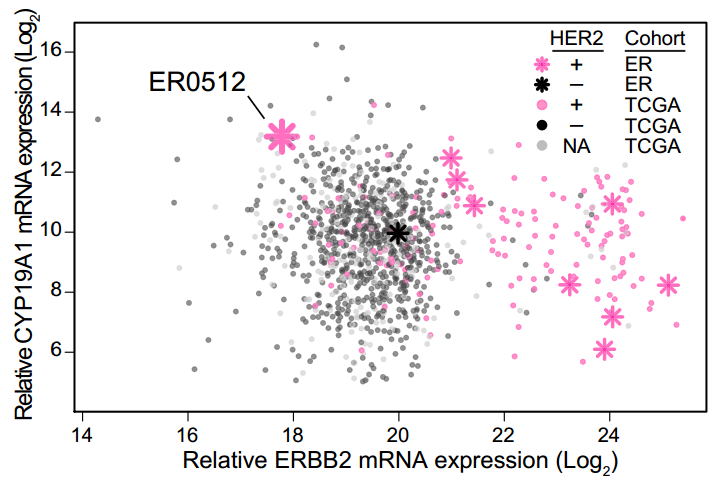
该患者CYP19A1表达很高
第五位超级响应者患有胃肠道间质瘤。Ta最初使用伊马替尼治疗,复发后又换用了舒尼替尼,获得完全缓解。
这位患者的肿瘤中,KIT基因高表达,而且KIT的11号外显子缺失,导致KIT蛋白被锁定在激活状态。
此外,舒尼替尼靶向的另外几种酪氨酸激酶——KDR、FLT1和FLT3,在这位患者的肿瘤中也高表达,这些是伊马替尼所不能抑制的[2]。此前也有研究发现,这些基因的表达与舒尼替尼的治疗效果有关[3,4],应当就是该患者治疗效果很好的原因。
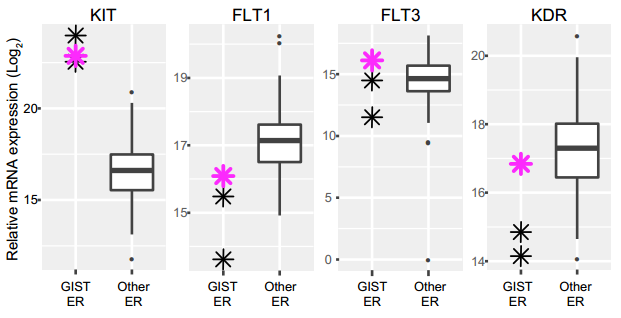
该患者肿瘤KIT、FLT1、FLT3和KDR均高表达
三、肿瘤的免疫状态
说到肿瘤就不能不说人体的免疫系统,这可是人体防癌抗癌的第一道防线。研究人员发现,这些超级响应者,整体上来说,肿瘤中的B细胞和NK细胞是比一般的患者更多的。其中一些超级响应者的肿瘤,在免疫方面还有独特的地方。
第六位超级响应者在免疫方面就很特殊。Ta患有转移性尿路上皮癌,在化疗、放疗和手术治疗失败后接受了PD-1抑制剂nivolumab的治疗,获得持续7个月的完全患者。接受类似治疗的尿路上皮癌患者,大约只有3%能获得这样的效果[5]。
这位患者的肿瘤中,PD-1和PD-L1的表达都很高,但这可能还不是最重要的。Ta的肿瘤里,MDM2基因和IFN-γ基因一并扩增了32倍。
MDM2是一个癌基因,可以抑制p53的活性。而IFN-γ可以增加MDM2的表达,进一步抑制p53[6],使得肿瘤的基因组更不稳定,发生更多突变,产生更多新抗原。另外,IFN-γ本身在抗癌免疫中也有着复杂的作用[7]。这些因素的共同作用,可能是这位患者超级响应的原因。
更有意思的是,MDM2这个基因,在这个病例里可能是患者治疗效果好的原因,但还有研究认为,它跟免疫治疗超进展有关[8]。同一个基因,可能既能让免疫治疗效果很好,也能让免疫治疗发生超进展。
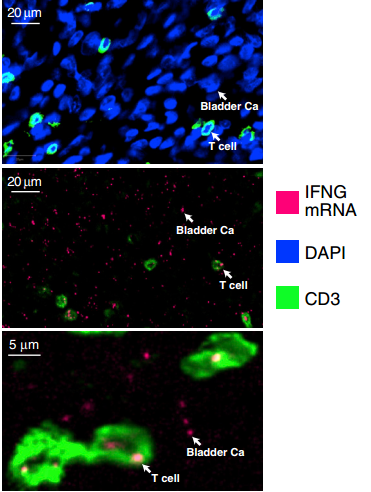
该患者的肿瘤细胞和肿瘤里的T细胞均表达IFN-γ
四、预后基因
研究还发现,几种特定的基因突变跟超级响应有关,比如IDH1-R132突变和POLE-V411L突变。这两个基因突变,前者影响DNA的甲基化,已被证明和胶质瘤预后良好有关[9],后者影响DNA的复制,造成大量突变,大约是同类肿瘤的100倍,进而产生大量新抗原,影响抗癌免疫。
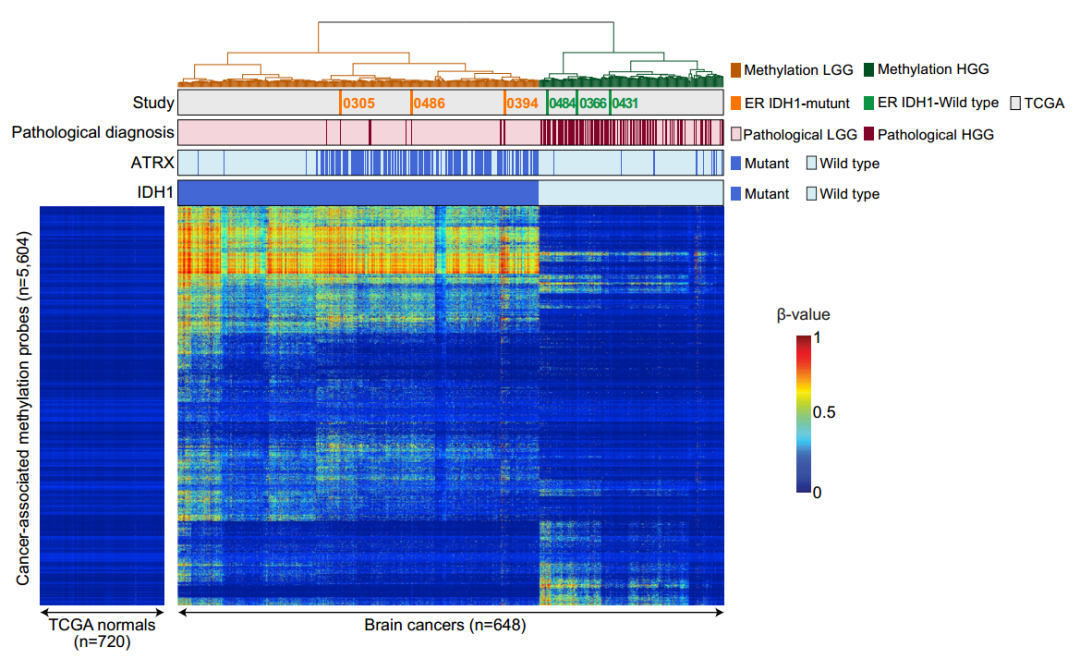
IDH1突变是胶质瘤超级响应的特征
五、天命之子
研究中,还有一位超级响应者同时具有四种超级响应者特征。这是一位IVb期子宫内膜癌患者,经紫杉醇、卡铂和替西罗莫司治疗后完全缓解5.8年。
这位患者的肿瘤,跟DNA修复相关的BRCA2、SLX4和WRN三个基因失活突变,使其对卡铂敏感,PIK3CA激活突变和PTEN失活突变使其对mTORC1抑制剂替西罗莫司敏感,MLH1基因被甲基化沉默使其微卫星不稳定,导致肿瘤微环境中免疫细胞丰富,是预后良好的一个特征。
一个患者集齐四种超级响应特征,可以说是天命之子了。
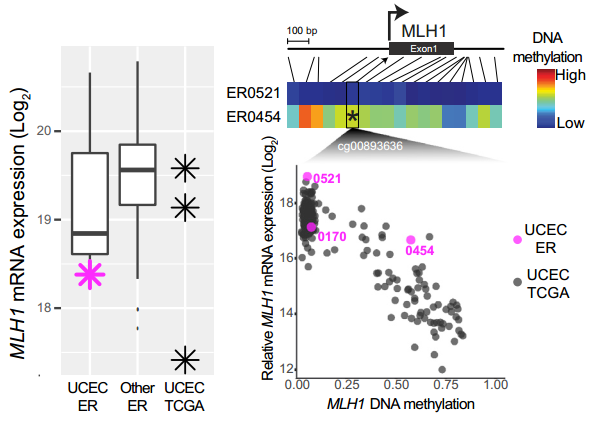
该患者肿瘤中MLH1基因被甲基化抑制
参考文献:
[1]. Wheeler D A,Takebe N, Hinoue T, et al. Molecular features of cancers exhibiting exceptionalresponses to treatment[J]. Cancer Cell, 2021, 39(1): 38-53. e7. [2]. Deininger M,Buchdunger E, Druker B J. The development of imatinib as a therapeutic agent forchronic myeloid leukemia[J]. Blood, 2005, 105(7): 2640-2653. [3]. Griffith M,Griffith O L, Krysiak K, et al. Comprehensive genomic analysis reveals FLT3activation and a therapeutic strategy for a patient with relapsed adultB-lymphoblastic leukemia[J]. Experimental hematology, 2016, 44(7): 603-613. [4]. Raymond E, DahanL, Raoul J L, et al. Sunitinib malate for the treatment of pancreaticneuroendocrine tumors[J]. New England Journal of Medicine, 2011, 364(6):501-513. [5]. Kim H S, Seo HK. Immune checkpoint inhibitors for urothelial carcinoma[J]. Investigative andclinical urology, 2018, 59(5): 285. [6]. Wang S, Zhao Y,Aguilar A, et al. Targeting the MDM2–p53 protein–protein interaction for newcancer therapy: progress and challenges[J]. Cold Spring Harbor perspectives inmedicine, 2017, 7(5): a026245. [7]. Benci J L,Johnson L R, Choa R, et al. Opposing functions of interferon coordinateadaptive and innate immune responses to cancer immune checkpoint blockade[J].Cell, 2019, 178(4): 933-948. e14. [8]. Kato S, GoodmanA, Walavalkar V, et al. Hyperprogressors after immunotherapy: analysis ofgenomic alterations associated with accelerated growth rate[J]. Clinical CancerResearch, 2017, 23(15): 4242-4250. [9]. Cancer GenomeAtlas Research Network. Comprehensive, integrative genomic analysis of diffuselower-grade gliomas[J]. New England Journal of Medicine, 2015, 372(26):2481-2498.
