【JCO】甲状腺未分化癌的免疫治疗
未分化癌是甲状腺肿瘤中恶性程度最高、预后最差的病理类型,治疗手段有限,且疗效欠佳。除了传统治疗方式,免疫治疗是目前恶性肿瘤治疗最受关注的领域,那么以PD-1/PD-L1单抗为主的检查点抑制剂类药物是否能打破甲状腺未分化癌目前的治疗僵局呢?就在本月Journal of Clinical Oncology(JCO) 杂志刊发了澳大利亚彼得·麦卡勒姆癌症中心Annette教授的评论文章,点评了一项PD-L1单抗治疗甲状腺未分化癌的II期临床研究,并提及了同样炽手可热的靶向药物对于甲状腺未分化癌的应用,以及靶向治疗和免疫药物的联合治疗,让我们共同期待这一难治性恶性肿瘤的治疗峰回路转柳暗花明的一天。

甲状腺未分化癌治疗手段有限,亟需突破性治疗打破僵局
甲状腺未分化癌(undifferentiated carcinoma) 又称为间变性甲状腺癌(anaplastic thyroid carcinoma, ATC),虽然在所有的甲状腺恶性肿瘤中只占1%~2%,但却因其恶性程度高,侵袭性强,预后差而令人谈之色变。甲状腺未分化癌多发生于60岁以上人群,可以是原发也可以由其他分化型甲状腺癌(乳头状癌多见)转化而来。甲状腺未分化癌的预后较差,绝大部分患者在确诊时均已出现远处转移,从而导致错失手术机会;而且该病摄碘率低,对放射性I131治疗不敏感,其他系统性治疗诸如化疗疗效也欠佳。目前甲状腺未分化癌的中位总生存期(median overall survival, mOS) 不足4个月,亟需更加有效的治疗方案改变这个窘况。
ORR高达69%,1年生存率80%,靶向治疗曙光初现
除了疗效欠佳的传统治疗方案,临床医师似乎对甲状腺未分化癌束手无策。随着近几年针对肿瘤驱动基因的靶向药物为恶性肿瘤的治疗开启了精准治疗新篇章,甲状腺未分化癌同样进入了靶向治疗时代。研究发现25%至50%比例的甲状腺未分化癌患者都存在BRAF V600E突变,这一突变也发生于甲状腺分化型癌及鳞状细胞癌中,当BRAF V600E突变合并TERT启动子突变时意味着预后更差。 BRAF抑制剂达拉非尼联合MEK抑制剂曲美替尼的方案于2018年获得美国食品和药物管理局(FDA)批准,用于治疗发生BRAF V600E突变的不可切除局部晚期或者转移性的无标准局部治疗方案的甲状腺未分化癌患者。这一适应症的批准基于一项II期临床试验,该实验招募的BRAF V600E突变甲状腺未分化癌患者的总体反应率高达69%,1年生存率为80%,这是甲状腺未分化癌史无前例的治疗突破,至此奠定了BRAF突变检测和靶向治疗的重要地位。
除了BRAF突变,还有其他驱动基因的异常改变可能具有潜在的有临床治疗价值,包括RET重排,ALK重排,NTRK融合,TSC2突变等,但这些基因变异的概率较小。还有一些突变频率较高的驱动基因譬如 TERT(75%)、TP53(63%)和RAS(24%),目前缺乏相应的治疗策略。一些多靶点酪氨酸激酶抑制剂(如乐伐替尼等)已也被尝试用于甲状腺未分化癌的治疗,但不同研究结果差异较大,分析认为这可能和甲状腺未分化癌患者通常合并有其他分化型甲状腺癌相关。
非初治患者7% CR,12% PR,免疫治疗崭露头角
除了靶向治疗,肿瘤治疗领域最具突破性的治疗方案当属免疫治疗。免疫治疗已经成为FDA批准,NCCN指南推荐用于恶性黑色素瘤、非小细胞肺癌等实体瘤的标准(联合)治疗方案之一,Capdevila等学者于今年5月于JCO发表的一篇名为 PD-1 Blockade in Anaplastic Thyroid Carcinoma 的文章,揭示了PD-1/PD-L1单抗类免疫治疗药物对于甲状腺未分化癌的疗效。
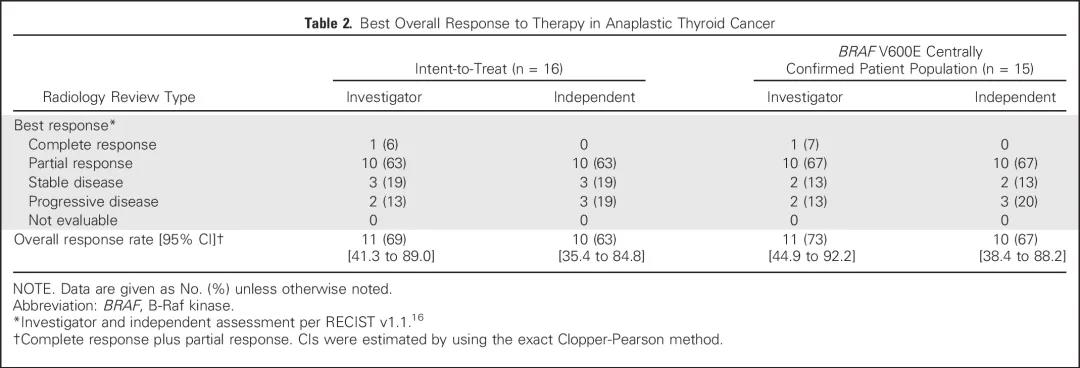
该I期和II期试验招募了42名转移性甲状腺未分化癌患者,这些患者大部分均接受过其他手段的治疗,包括手术(67%)、放疗(71%)和至少一种全身治疗(化疗和靶向治疗,60%)。所有患者采用PD-1抑制剂spartalizumab(PDR001,诺华研发的PD-1人源IgG4抗体)400 mg静脉用药,4周为一周期。结果提示spartalizumab 总缓解率(ORR)为19% ,其中3例更是达到了完全缓解(7%),5例评价为部分缓解(12%),还有2例患者经免疫相关响应标准(immune-related response criteria, irRC)评估也达到部分缓解。观察到的药物响应与BRAF V600E突变与否无关。中位反应持续时间(DOR)未达到,但研究截止时观察到的反应持续时间从16.7周到1.6年不等,有11名患者接受了50周甚至更长时间的治疗。治疗相关不良反应与其他实体瘤的免疫治疗类似。尽管该研究样本数并不太多,但却是目前针对甲状腺未分化癌实施免疫治疗最有说服力的临床研究。
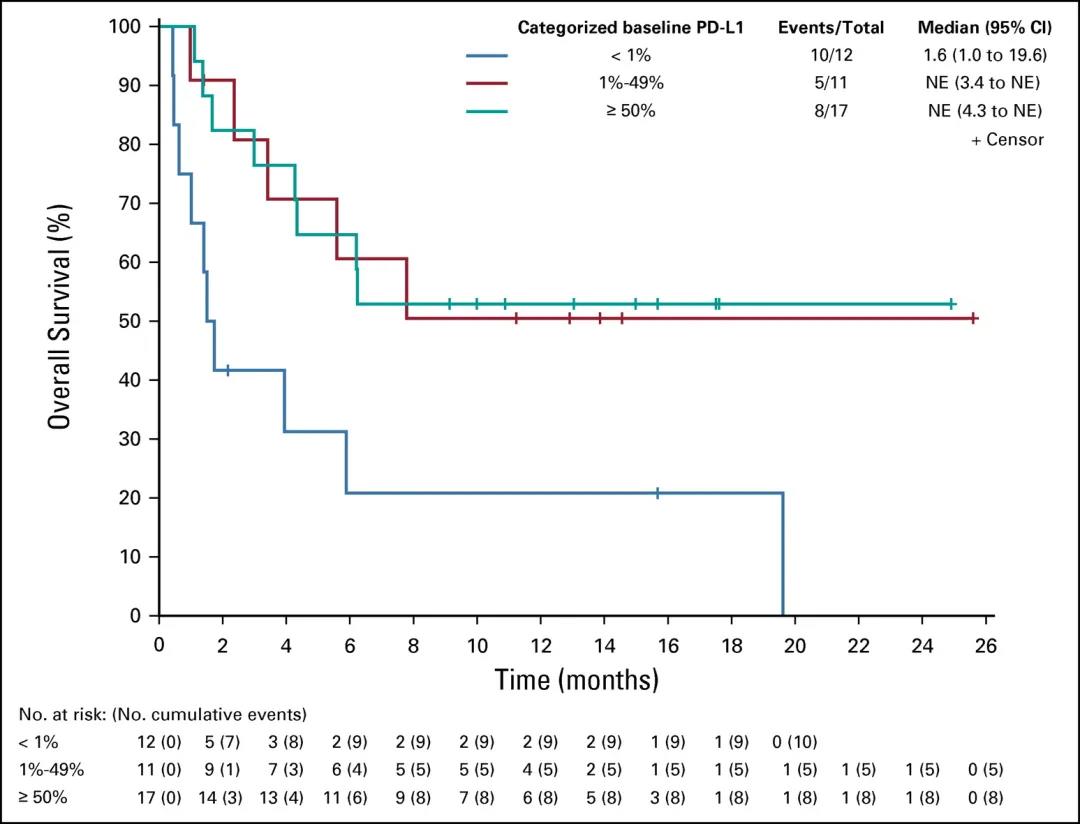
该研究提示对于甲状腺未分化癌这一让临床医师感到棘手的恶性肿瘤,免疫治疗或可成为极具潜力的突破口。那么是否具有标记物能初步预测甲状腺未分化癌对于免疫治疗的反应呢?该研究分析数据发现,几乎所有从spartalizumab治疗获益的患者均为PD-L1表达阳性(22C3抗体阳性细胞率≥1%)。PD-L1阳性患者的ORR可达29%( 13.2%~48.7%),中位OS尚未达到(研究终止部分患者尚存活),而PD-L1小于1%的患者的ORR为0%,中位OS为1.6个月(1.0个月~19.6个月)。这一初步结论提示以后进行类似研究如根据PD-L1表达情况进行分层分析更能反映客观情况。
其他的疗效预测指标,比如&γ;-干扰素(RNA水平检测,平均斯皮尔曼系数-0.67)或许能提示缓解深度(DpR),目前比较热门的指标肿瘤突变负担(TMB) 在本研究组群患者中均呈现比较低的水平(中位数3.78 mut/Mb),且未发现TMB与疗效具有关联。尤其引人注意的是,前面提到的BRAF突变和PD-L1的表达情况及免疫治疗的临床获益均无明显相关性。
该研究证实了针对PD-1/PD-L1的免疫治疗可能是甲状腺未分化癌行之有效的治疗策略之一,当然对此还有一些问题需要明确,首先本研究尚未达到中位反应持续时间,那么spartalizumab对甲状腺未分化癌的缓解持续时间究竟如何尚无法得知,另外接受spartalizumab治疗无效的患者其耐药机制及治疗策略也是值得探讨的问题。
免疫治疗联合靶向治疗也是当前研究方向之一,目前正在进行的临床试验包括西米普利单抗联合达拉非尼和曲美替尼的研究(NCT04238624), 乐伐替尼联合帕姆单抗的研究(NCT04171622), 阿特朱单抗联合化疗或靶向药物的试验(NCT03181100)。这些研究结果将有望揭示甲状腺未分化癌的疗效预测标识物,探索出基于靶向治疗和免疫疗法却更具突破性的方案,让我们拭目以待。
参考文献
Annette M. Lim, et al, Immunotherapy for Anaplastic Thyroid Carcinoma; [J ]Journal of Clinical Oncology, Aug 2020
