Nature新研究深度揭示肿瘤微环境疯狂噬糖效应

4月7日,nature杂志在线发表了题为“Cell-programmed nutrient partitioning in the tumour microenvironment”(肿瘤微环境中细胞程序化营养分配机制)的一项研究。这项研究表明了肿瘤微环境(TME)作为一个功能整体的高嗜糖有氧糖酵解作用,也进一步表明高有氧糖酵解的肿瘤微环境为肿瘤的免疫逃逸、进展起到了重要作用。
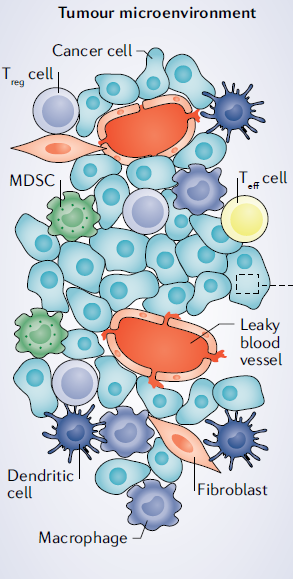
TME,主要由肿瘤细胞,及其周围的免疫和炎症细胞,肿瘤相关的成纤维细胞,和附近的间质组织,微血管,以及各种细胞因子和趋化因子构成,是一个复杂的综合系统。
肿瘤组织噬糖的最早发现:Warburg效应
上世纪20年代,诺贝尔生理及医学奖得主德国生物化学家沃伯格(Otto Heinrieh Warburg)通过测定动物中正常组织与肿瘤组织中流入动脉及流出静脉中血糖变化,发现即便在氧供充足环境中,肿瘤组织更倾向于通过糖酵解方式来获取能量。
肿瘤组织噬糖的应用:FDG-PET
2009年,Vander教授在Science发文,进一步证实了Warburg效应的存在及对肿瘤细胞生长的重要性。利用肿瘤的高葡萄糖摄取特性,开发了用于肿瘤诊断及判断治疗效果的方法(FDG-PET)。并认为膳食补充及严格葡萄糖控制有助于治疗肿瘤。
肿瘤组织噬糖研究:2020年热度不减,机制探索初现曙光
2020年,Science Signaling、Nature Review Cancer陆续发文进一步明确肿瘤Warburg效应的机制,探讨多种基因突变或自身免疫功能发挥与肿瘤细胞特异性代谢的关系,有助于更好地开发肿瘤治疗方法或增强药物疗效。
2020年11月,Sci signal刊载了Birts教授团队的研究成果。Birts教授使用人类乳腺癌细胞模型,探究了抑癌基因p53与癌症细胞有氧糖酵解的关系。P53是调节代谢平衡和减少代谢失衡下细胞损伤的关键基因,由于肿瘤缺乏成熟的血供,加之逐渐增加的有氧糖酵解使乳酸聚积,导致TME酸化,进而抑制LDH,从而导致了肿瘤细胞内NADH:NAD+比例增加。这可导致调节肿瘤细胞糖酵解的p53发生突变,推动代谢失衡,进一步增加肿瘤细胞有氧糖酵解水平,使肿瘤细胞在代谢失衡的环境中继续增殖,而高速的增殖促进了存活肿瘤细胞的筛选及迭代导致了肿瘤的进一步进展。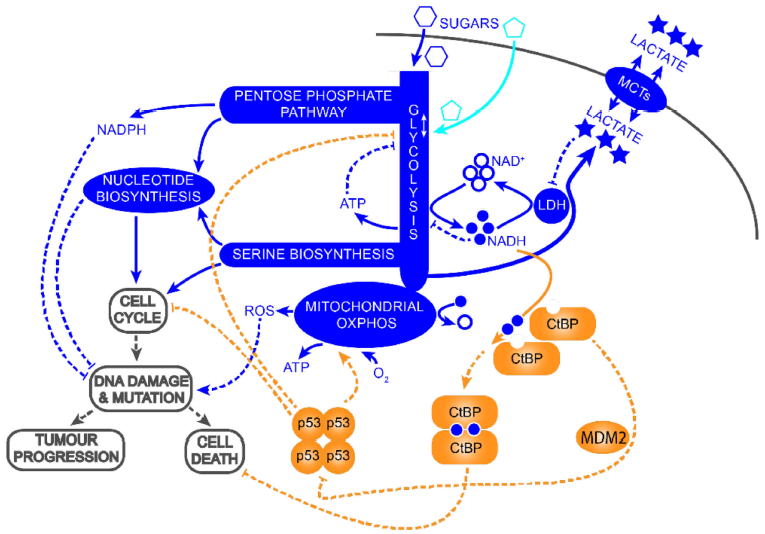
NADH-CtBP-p53通路调控糖酵解稳态模型
肿瘤组织噬糖2021 Nature研究:肿瘤微环境内的癌细胞摄取葡萄糖的2/3,骨髓细胞摄取另外1/3
最新的nature研究通过使用PET示踪剂来定位测量TME中特定细胞亚群对葡萄糖摄取进行研究。
该研究进一步证实了TME摄取葡萄糖能力要远优于正常组织。同时发现TME中单个免疫细胞摄取葡萄糖水平高于肿瘤细胞,但就TME整体而言,肿瘤细胞仍是嗜糖最高的细胞群体。研究者将每个细胞对葡萄糖的摄取乘以每个类型细胞数量,发现癌细胞(CD45-)约占总葡萄糖摄取的2/3,髓系免疫细胞(CD11B+)占另外1/3,其他免疫细胞(CD3+及其他CD45+)的贡献微不足道。
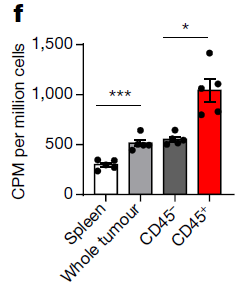
肿瘤较正常组织细胞摄取更多葡萄糖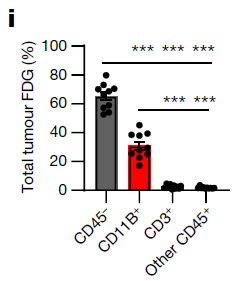
肿瘤组织中癌细胞整体摄入更多葡萄糖(注:文中CD45-细胞主要为癌细胞,CD45+细胞为免疫细胞,CD11B+细胞为髓系免疫细胞,CD3+细胞为T细胞)
研究通过对CD45+流式细胞分析,孤立得到了CD11B+标记的髓系细胞。与其他的CD45+的细胞相比,髓系细胞(主要是巨噬细胞)摄取的葡萄糖水平最高。
TME中的髓系免疫细胞(巨噬细胞)可分为M1型和M2型巨噬细胞。M1型巨噬细胞可以通过吞噬作用及介导Th1应答来杀死肿瘤细胞,抑制肿瘤细胞生长;M2型巨噬细胞则通过产生细胞因子及介导Th2应答,促进组织修复、血管形成、产生免疫抑制,进一步助长了肿瘤的演进。目前越来越多的研究发现肿瘤细胞中糖酵解转录基因的表达可以诱导TME免疫抑制,并直接诱导免疫抑制型髓样细胞聚集。即肿瘤特定的微环境迫使进入肿瘤的巨噬细胞的表型向着有利于肿瘤发展的方向演变,即M2型巨噬细胞的生成。据此可以推断,在TME中摄取大量葡萄糖的巨噬细胞,在大量的葡萄糖供应及有氧糖酵解下,将促进其不断向M2型转变,从而促进肿瘤的进展。
TME是一个功能整体,肿瘤细胞可以看做是种子,而其他成分看做是土壤,肿瘤细胞与环境中其他成分相互影响、共同进化,促进了肿瘤的产生。肿瘤细胞、髓样细胞高有氧糖酵解,TME中聚积了大量乳酸、H+,进而影响浸润T细胞增殖、存活及细胞毒性和细胞因子的产生,破坏TME中的免疫平衡,利于肿瘤细胞免疫逃逸及进展。
肿瘤微环境中脂肪的作用:2020 Nature子刊研究提示可能促进M2向M1转化
而与关注高糖供给不同,另一项最近研究关注了高脂供给对于肿瘤的影响。2020年,Nature子刊Signal Transduction and Targeted Therapy的一项动物试验表明,高脂饮食可抑制结直肠癌(CRC)细胞的腹膜播散。该研究指出,高脂摄入可使巨噬细胞由M2型转化为M1样表型,且刺激脂肪组织巨噬细胞中TLR4依赖的M1巨噬细胞激活和吞噬,进一步增强内脏脂肪中CD4+和CD8+ T细胞的招募(通过Cxcl10)和激活(通过M1细胞因子),最终阻止结直肠癌转移播散。由此可见,或许通过提高饮食中脂肪供能比可以抑制肿瘤的进展,提高生存率。
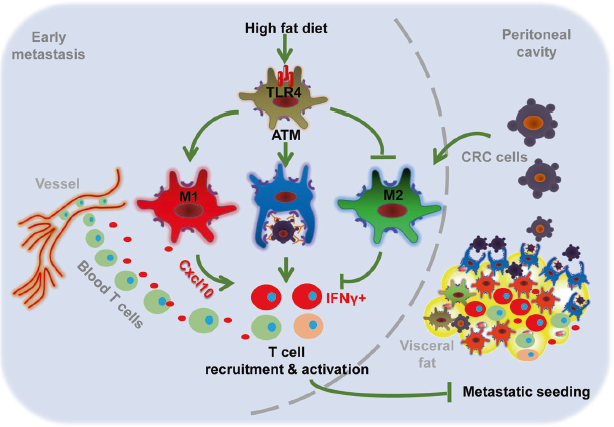
高脂饮食促进M1型巨噬细胞活化
总结
经过近100年的不断研究,科学家对肿瘤代谢的认识不断深化。沃伯格教授百年前发现肿瘤组织对糖的摄取更旺盛,现今,我们的研究能深入到肿瘤微环境内,探讨不同细胞的代谢与肿瘤发生发展的关系。最后,引用Nature这篇最新研究的篇首语来回顾这百年至今研究发展的精髓:“肿瘤细胞通过沃伯格代谢特异性地消耗葡萄糖,这是PET肿瘤影像检查的基础。肿瘤浸润免疫细胞也依赖于葡萄糖,而肿瘤微环境内这些受损的免疫细胞代谢帮助肿瘤细胞实现免疫逃逸。” 因此,我们在临床上,要限制肿瘤患者糖的摄入,以减轻糖代谢对肿瘤发生发展的影响。
参考文献:
1. Reinfeld BI, et al. Cell-programmed nutrient partitioning in the tumour microenvironment. Nature. 2021 Apr 7. doi: 10.1038/s41586-021-03442-1. Epub ahead of print. PMID: 33828302.
2.Warburg O, Wind F, Negelein E. THE METABOLISM OF TUMORS IN THE BODY. J Gen Physiol. 1927 Mar 7;8(6):519-30. doi: 10.1085/jgp.8.6.519. PMID: 19872213; PMCID: PMC2140820.
3. Vander Heiden MG, et al. Science 2009; 324:1029-1033
4. Birts CN, et al. Sci Signal. 2020 May 5;13(630):eaau9529. doi: 10.1126/scisignal.aau9529
5. Leone RD, Powell JD. Nat Rev Cancer. 2020 Sep;20(9):516-531. doi: 10.1038/s41568-020-0273-y. Epub 2020 Jul 6.
6. Birts CN. p53 is regulated by aerobic glycolysis in cancer cells by the CtBP family of NADH-dependent transcriptional regulators. Sci Signal. 2020 May 5;13(630)
7. Xiang, W, et al. Dietary fats suppress the peritoneal seeding of colorectal cancer cells through the TLR4/Cxcl10 axis in adipose tissue macrophages. Sig Transduct Target Ther 5, 239(2020).
