当biomarker遇上免疫治疗
高肿瘤突变负荷无法预测所有癌症对免疫检查点抑制剂的疗效
研究背景
高肿瘤突变负荷(TMB-H)可作为预测免疫检查点抑制剂(ICB)疗效的生物标志物,这主要是由于肿瘤突变可能产生免疫原性肿瘤新抗原。通过靶向FoundationOne CDx检测对九类肿瘤进行评估,近期ICB泛癌种获批用于治疗任意TMB-H肿瘤,但该生物标志物的实用性并未在所有癌症中得到充分证实。
患者和研究方法
应用癌症基因组图谱中包含的10000多例患者肿瘤的数据,对检测TMB的方法进行比较,并确定预测的新抗原负荷和CD8 T细胞之间的相关性。从客观缓解率(ORR,N=1551)和总生存率(OS,N=1936)两方面分析TMB与ICB治疗结果之间的相关性。
研究结果
在CD8 T细胞水平与新抗原负荷呈正相关的癌症类型如黑色素瘤、肺癌和膀胱癌中,TMB-H肿瘤对ICB治疗的ORR为39.8%[95%置信区间(CI) 34.9~44.8],显著高于低TMB(TMB-L)肿瘤(OR=4.1, 95% CI 2.9~5.8,P<2×10-16)。在CD8 T细胞水平与新抗原负荷无关的癌症类型如乳腺癌、前列腺癌和胶质瘤中,TMB-H肿瘤的ORR不到20%(ORR=15.3%,95% CI 9.2~23.4,P=0.95),且显著低于TMB-L肿瘤(OR=0.46,95%CI 0.24~0.88,P=0.02)。在评估的患者队列中,两种类型癌症的总体ORR间无显著性差异(P=0.10)。对OS进行分析并将TMB视为连续变量,得到了相同的结果。
研究结论
本研究的分析结果未能支持将TMB-H作为预测所有实体肿瘤ICB疗效的生物标志物。
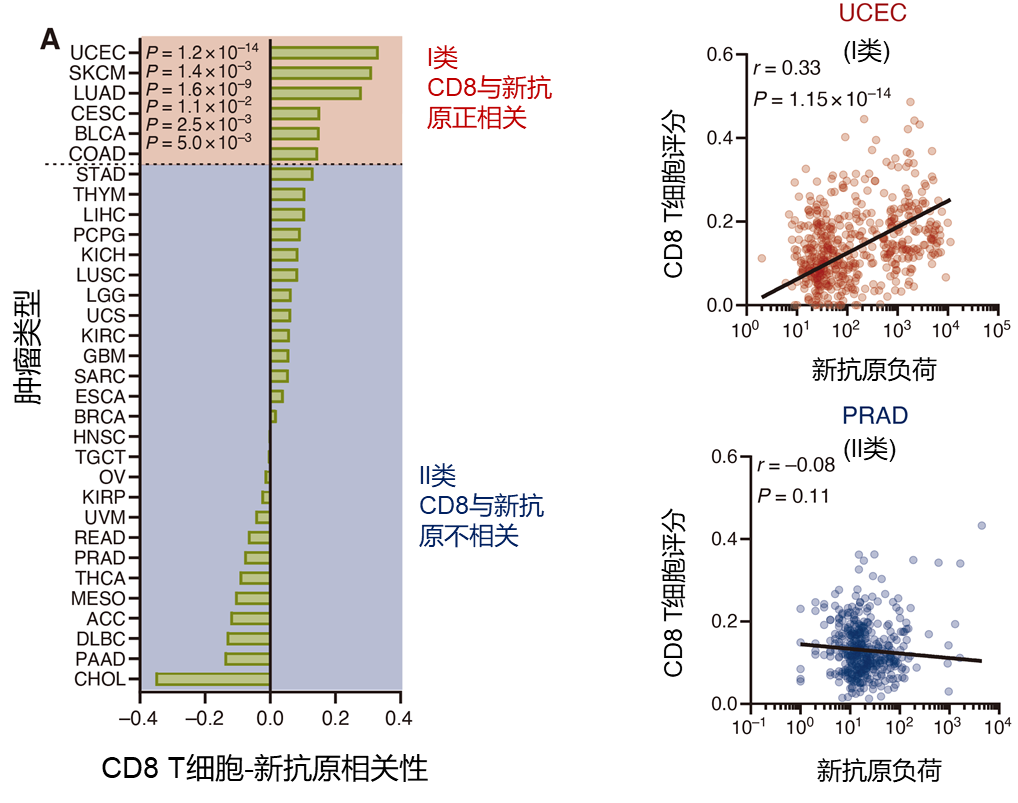
A:根据RNAseq检测的CD8 T细胞浸润和肿瘤新抗原负荷之间的Spearman相关性确定了两类肿瘤,一类是新抗原负荷增加与CD8 T细胞浸润增加显著相关(I类),另一类是新抗原负荷增加与CD8 T细胞浸润增加不相关(II类)。右侧为相关图举例
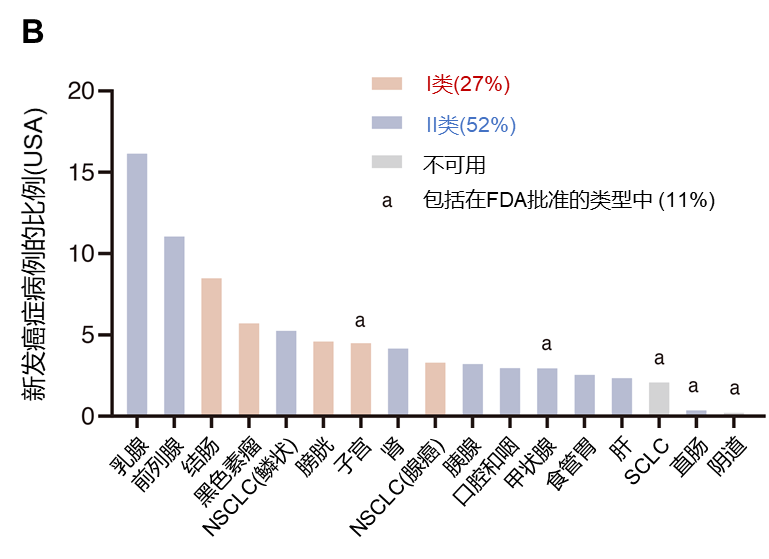
B:美国新诊断的常见癌症类型,约占实体肿瘤的80%以上。红色表示I类癌症,其CD8 T细胞水平与新抗原负荷呈正相关;蓝色表示II类癌症,其CD8 T细胞水平与新抗原负荷无关
图1. 美国大多数新发癌症病例均来自于CD8 T细胞浸润与新抗原负荷无关的肿瘤类型
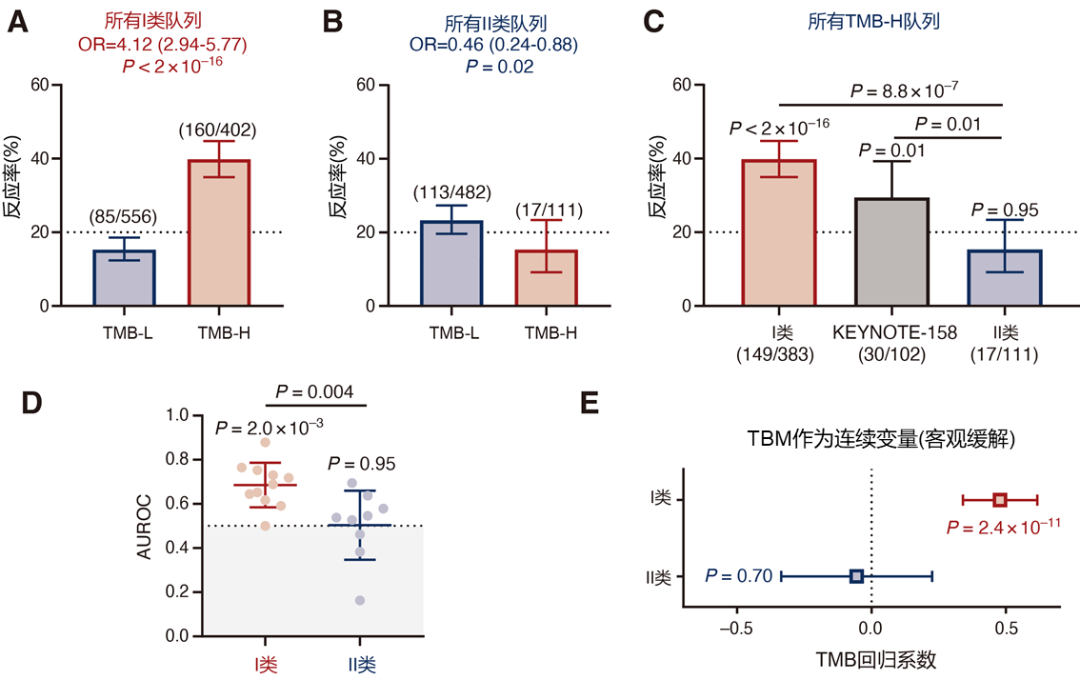
图2(A) 新抗原负荷与CD8 T细胞水平相关的I类癌症队列中的ICB反应率(B) 新抗原负荷与CD8 T细胞水平不相关的II类癌症队列中的ICB反应率(C) 所有TMB-H队列的ICB反应率(D) I类和II类肿瘤的受试者工作特征(AUROC)曲线下面积值代表在TMB阈值范围内对ICB反应率的预测价值,其中0.5代表随机概率,1.0代表最佳预测(E) 对I类和II类肿瘤中TMB预测ICB疗效的能力进行Logistic回归分析,其中正的系数代表TMB- H肿瘤的反应率增加。将TMB作为连续变量,将单个队列作为随机效应处理(F) TMB- H肿瘤与TMB-L肿瘤患者ICB治疗后总生存率的风险比,负的log2(风险比)代表TMB- H肿瘤患者具有更好的结局。采用Cox比例风险模型进行分析,队列类型作为分层变量(G) ICB治疗后总生存率的风险比,将TMB作为一个连续变量,阴性log2(风险比)代表TMB-H肿瘤患者具有更好的结局。采用Cox比例风险模型进行分析,队列类型作为分层变量。
专家点评
癌症基因组体细胞突变内源性和外源性都可能参与的一个多因素过程,前者包括DNA修复基因或参与DNA复制基因的缺陷或改变如聚合酶ε(POLE),后者的原因包括吸烟或紫外线暴露等。体细胞高度突变可能导致突变基因编码的蛋白修饰,可能作为肿瘤特异性新抗原激活特异性抗肿瘤免疫反应。2013年,Immunity杂志中一篇综述指出,肿瘤所携带突变越多产生的新抗原可能就越多,从而更易被免疫细胞识别,引起强烈的抗肿瘤免疫反应。
2020年6月,美国FDA批准K药用于治疗使用FDA指定的检测方法TMB-H的无法切除或转移性实体肿瘤,包括成年和儿科患者,具体标准是TMB≥10个突变/Mb。FDA批准此适应证主要依据Pembrolizumab在多癌种中开展的Keynote-158研究,该研究纳入的癌种包括小细胞肺癌、宫颈癌、子宫内膜癌、肛门癌、阴道癌、神经内分泌瘤、唾液腺癌、甲状腺癌、间皮瘤及胆道癌共10个癌种。后续KEYNOTE-119(三阴性乳腺癌)/KEYNOTE-061(胃癌)/KEYNOTE-199(前列腺癌)等研究中验证了TMB-H与免疫单药治疗疗效之间的相关性。KEYNOTE-158研究不同癌种ORR数据中,小细胞肺癌、宫颈癌、子宫内膜癌、阴道癌以及神经内分泌瘤在TMB-H人群中均达到较高ORR(17%-47%),这些癌种占到试验人群80%左右;而在其他剩余癌种中达到ORR人群较少或本身入组人群较少,数据尚不稳固。也有几项临床试验(CheckMate-227、NEPTUNE)没有能够通过TMB准确预测抗肿瘤免疫治疗疗效。
TMB-H实体瘤的免疫治疗设想是基于肿瘤突变可能产生免疫原性新抗原,新抗原增加和CD8 T细胞计数增加呈正相关,而CD8 T浸润肿瘤是免疫治疗效果好的基础。来自MD安德森癌症中心发表此项研究是一项大型回顾性研究数据,该文从多个角度分析,质疑FDA加速审批的——免疫检查点抑制剂适应证之一的TMB-H泛癌种。该研究的回顾性分析发现,并非所有TMB-H癌种的CD8 T细胞计数就会升高,CD8 T细胞水平与新生抗原负荷呈正相关癌症类型如黑色素瘤、肺癌和膀胱癌中,TMB-H肿瘤对ICB治疗的ORR为39.8%,显著高于低TMB(TMB-L)者;而在CD8 T细胞水平与新生抗原负荷无关癌症类型如乳腺癌、前列腺癌和胶质瘤中,TMB-H肿瘤的ORR不到20%。因此TMB-H或不适合作为预测所有癌症的免疫治疗疗效生物标志物。消化系统肿瘤常见的结肠癌划分至I类癌症,TMB-H可作为免疫治疗疗效预测指标,但胰腺、食管、胃食管结合部癌划分至II类癌症,TMB-H预测期免疫治疗疗效的证据尚不充分。
2021年3月,NEJM上发表的一篇LETTER同样对TMB-H的免疫治疗疗效预测价值提出了质疑。1661例TMB-H的泛实体瘤患者接受治疗后,TMB的预测价值仍然仅仅体现在NSCLC、头颈部鳞癌和黑色瘤上,其他癌种观察不到TMB-H的预测价值。分析指出,相比于TMB,我们更应该关注与TMB相关的基因表型差异,TMB-H的MMR型肿瘤免疫治疗疗效与TMB-L的MMR型肿瘤无任何差异,而MSIH及POLE的免疫预测价值才是重点。
TBM-H的肿瘤是否能够产生足够有效的肿瘤新生抗原,而新抗原识别也仅是抗肿瘤免疫起始的初级步骤,TMB仍然是一个在临床实践中尚存争议的免疫疗效预测标志物,它对OS预测价值的重复性和稳定性可能还不如 CTILs/ MSIH/ POLE/ D突变等。TMB的不同算法及cutoff值的划分也会影响TMB预测价值;在很多采用WES分析中,TMB只包含错义突变,而没有纳入其他突变类型。因此在临床实际应用中,对于大多数非免疫治疗优势癌种而言,TMB的临床实践之路不仅需要在检测稳定性/重复性/可比较性上提高之外,联合其他一些指标进行预测可能更有实际价值。
PD-L1和炎症基因表达与纳武利尤单抗±伊匹单抗治疗胃癌/胃食管交界癌疗效的相关性分析
研究目的
在晚期胃癌/胃食管交界癌(GC/GEJC)中,需要识别对免疫检查点抑制剂治疗有应答的生物标志物。
研究方法
在对CHECKMATE 032(GC/GEJC队列)的事后探索性分析中,评估纳武利尤单抗±伊匹单抗(NIVO±IPI)疗效与程序性死亡配体1(PD-L1)表达或炎症基因表达之间的关系,应用 DAKO PD-L1 IHC 28-8 pharmDx 检测基因表达,定义为PD-L1阳性的肿瘤细胞比例(TC%)或联合阳性评分(CPS)。
研究结果
对所有治疗方案进行的汇总分析中,在较高截断值(≥5和≥10) 的情况下,CPS法测定的PD-L1表达与TC%相比,在有效性(ORR和OS)有增加的趋势。在这项研究中,在CPS≥5和≥10的截断值下PD-L1阳性肿瘤患者的ORR分别为19%和26%,而在同等的TC%截断值下的ORR分别为8%和9%。与PD-L1阴性的患者相比,PD-L1阳性(CPS截断值定义为≥5和≥10)患者的生存期更长。在NIVO 1mg/kg + IPI 3mg/kg(NIVO 1 + IPI 3)亚组中观察到了相似的结果。多个炎症基因标签/转录物,包括由4个基因(CD274、CD8A、LAG3和STAT1)组成的标签,与NIVO±IPI治疗反应存在显著相关性。
研究结论
在GC/GEJC患者中,与TC%表示的PD-L1表达相比,CPS表示的PD-L1表达与NIVO±IPI疗效的相关性更强。炎症标签也与NIVO±IPI反应有关,值得进一步探索。
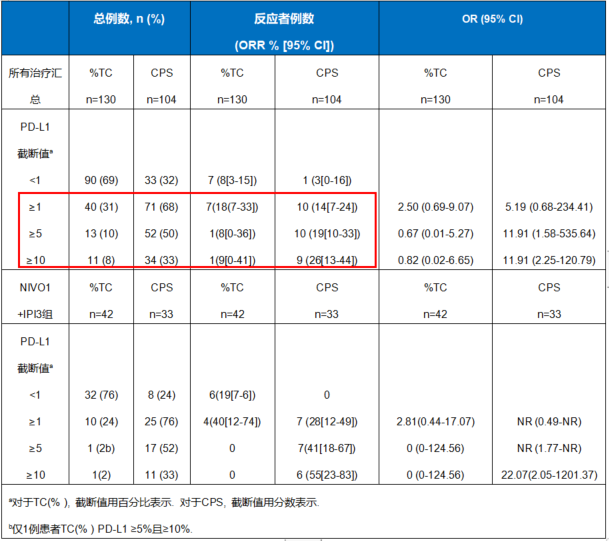
表1:TC(% )和CPS的比例和反应率
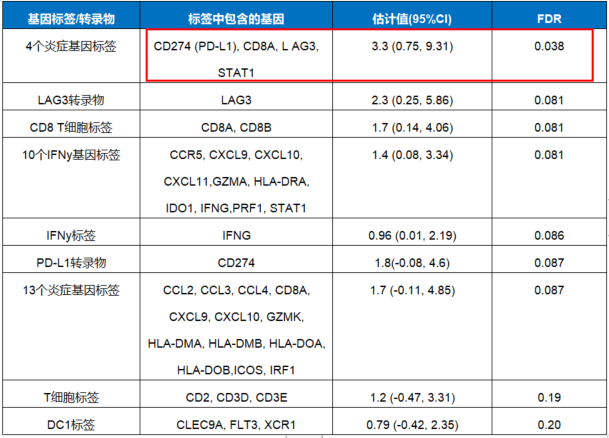
表2:基因表达标签或单个转录物及其与反应的关系:所有治疗方案汇总
专家点评
PD-L1通常在各种类型免疫细胞和一些特定癌细胞上表达,辅助癌细胞逃避免疫系统监测,在NSCLC的相关研究中,PD-L1表达与PD-1抗体及PD-L1抗体疗效的相关性在数个研究中得到了证实。PD-L1免疫组化检测已经被FDA批准作为伴随诊断用于指导帕博利珠单抗单药一线治疗NSCLC,作为补充诊断用于纳武利尤单抗二线治疗NSCLC,但PD-L1用于胃癌、食管癌等消化系统肿瘤的免疫检查点抑制剂疗效的预测尚未得到统一的结论。在消化系统肿瘤领域,单独评估肿瘤细胞中PD-L1的表达肿瘤比例评分(TPS)不能反映总免疫耐受状态,无法预测免疫检查点抑制剂疗效。随后学者又探索评估了联合阳性评分(CPS)的疗效预测价值,并已经在多项消化系统肿瘤相关RCT中进行了重要探索性分析,其疗效预测价值也得到了越来越多专家及学者的认可。
然而不同RCT中关于GC的PD-L1表达CPS的cutoff值对ICI疗效的预测却议论纷纷,莫衷一是。KEYNOTE-062中,CPS≥10患者较CPS≥1患者未见获益更多,但在 CPS≥10患者中,免疫单药对比化疗可获益更多;Checkmate 032中,对比CPS 1/5/10,5可能是最佳的CPS cutoff值;广受关注的Checkmate-649中,CPS≥5患者较总体人群和CPS≥1患者可获益更多,虽然NCCN指南推荐CPS≥5的人群,但FDA最近刚刚批准纳武利尤单抗的全人群适应证。这项研究对 CHECKMATE 032(GC/GEJC队列)的事后探索性分析,在CPS≥5和≥10截断值下PD-L1阳性者ORR分别为19%和26%,而在同等TC%截断值下ORR分别为8%和9%;与PD-L1阴性患者相比,PD-L1阳性(CPS截断值定义为≥5和≥10)者生存期更长;在NIVO 1mg/kg + IPI 3mg/kg(NIVO 1 + IPI 3)队列的结果类似。再次证明了,CPS对单免和双免疗效的预测价值,CPS≥5可能是更为合适的截值。
越来越多的研究探索了免疫微环境分析对免疫疗效预测的判断价值。炎症基因表达分析(GEP)揭示了ICI治疗诱导的转录和肿瘤微环境改变的相关性,既往报道过GC患者中免疫相关基因表达特征与PD-1抑制剂单药治疗疗效的相关性。既往GEP研究文献中,与GEP相关性最强基因组集中于T细胞炎症相关溶细胞性活动方面,其次主要集中在肿瘤微环境有关其它细胞类型,例如血管内皮细胞、髓细胞等方面,最新也有文献表明WNT癌基因通路相关基因也参与了GEP中。不同肿瘤之间GEP也存在个体性差异。本探索性研究中评价的9个基因表达特征或单个转录本中的7个,包括4个炎症基因特征(CD274/ PD-L1、 CD8A、 LAG3和 STAT1),显示与客观缓解相关的证据。这些数据对于理解ICI的作用机制和未来设计免疫相关试验具有重要意义。
消化系统肿瘤异质性尤为突出,肿瘤本身的异质性可能与微环境之间的异质性是相辅相成的过程。基于此原因,消化系统肿瘤免疫治疗疗效预测的探索还有很长一段路要走。
参考文献
McGrail DJ, Pilié PG, Rashid NU, et al. High tumor mutation burden fails to predict immune checkpoint blockade response across all cancer types. Ann Oncol. 2021 Mar 10:S0923-7534(21)00123-X.
Lei M, Siemers NO, Pandya D, et al. Analyses of PD-L1 and Inflammatory Gene Expression Association with Efficacy of Nivolumab{plus minus}Ipilimumab in Gastric Cancer/Gastroesophageal Junction Cancer. Clin Cancer Res. 2021 Mar 29:clincanres.2790.2020.
