FGFR抑制剂BGJ398对白血病细胞生物学行为及耐药的影响
成纤维细胞生长因子(fibroblast growth
factor,FGF)家族成员能够调节细胞增殖、迁移和分化,在肿瘤性疾病的发生和转移等过程中发挥重要作用,FGF受体(FGF
receptor,FGFR)抑制剂具有抗肿瘤活性。探讨FGFR抑制剂BGJ398对白血病耐药细胞株K562/ADM增殖、迁移、凋亡和耐药的影响。方法:将K562/ADM细胞分为空白对照组、阴性对照组和实验组,采用细胞计数试剂框-8(cell counting
kit-8,CCK-8)法检测细胞的增殖抑制情况。采用transwell小室法检测BGJ398对白血病细胞迁移能力的影响。采用流式细胞术检测各组细胞的凋亡率。采用CCK-8法检测K562/ADM细胞对阿糖胞苷(cytarabine,Ara-c)、柔红霉素(daunorubicin,DNR)药物敏感性的变化。采用蛋白质印迹法(Western
blot)测定FGFR抑制剂BGJ398对耐药细胞株MDR1耐药基因的影响。结果:FGFR抑制剂BGJ398能显著抑制K562/ADM细胞的增殖,并具有浓度依赖性,BGJ398的作用浓度分别为5、10、15
mol/L时抑制作用明显。实验组迁移细胞数为11.00±3.00,较阴性对照组(57.67±14.57)和空白对照组(43.00±4.00)明显减少(P<0.05)。实验组细胞凋亡率为(81.49±5.38)%,明显高于空白对照组(10.09±1.36)%和阴性对照组(7.64±1.32)%(P<0.001)。FGFR抑制剂能显著降低Ara-c、DNR对K562/ADM细胞的半数抑制浓度(half
maximal inhibitory concentration,IC50);Western
blot结果显示,BGJ398能显著降低耐药基因MDR1的蛋白表达水平,逆转白血病细胞耐药。结论:FGFR抑制剂BGJ398能有效地抑制白血病耐药细胞株K562/ADM的增殖和迁移,促进凋亡,逆转耐药,FGFR有望成为白血病治疗的新靶点。
成纤维细胞生长因子(fibroblast growth factor,FGF)是一类由垂体和下丘脑分泌的多肽,目前已发现23种家族成员,FGF家族成员有相同的核心结构,能够调节细胞增殖、迁移和分化,在肿瘤性疾病的发生和转移等过程中发挥重要作用[1]。FGF必须与FGF受体(FGF receptor,FGFR)结合才能发挥其生物学活性,进而启动细胞内信号转导,目前已经确认的FGFR有4种,他们都是一类穿膜的酪氨酸激酶受体,分别由4个孤立基因编码,这4种受体功能相近,均参与细胞的增殖、迁移和分化等过程[2-5]。有研究[6]表明,FGF与白血病的发病有关,FGFR抑制剂能有效地阻断FGF与FGFR结合,但对白血病细胞耐药的影响未见报道。本研究拟探讨FGFR抑制剂BGJ398对耐药细胞株K562/ADM增殖、凋亡及耐药的影响。
1 材料和方法
1.1 材料
FGFR抑制剂BGJ398购自美国MedChemExpress公司;人慢性髓细胞性白血病耐药细胞K562/ADM由滨州医学院附属医院临床实验室保存;细胞计数试剂框-8(cell counting kit-8,CCK-8)购自大连美仑生物技术有限公司;Annexin Ⅴ-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)/碘化丙啶(prodium iodide,PI)细胞凋亡检测试剂框购自南京凯基生物科技发展有限公司;核蛋白和胞浆蛋白提取试剂框购自南京凯基生物科技发展有限公司;RPMI-1640培养基购自美国Hyclone公司;二甲基亚砜(dimethyl sulfoxide,DMSO)购自美国σ公司;MDR1(即P-gp,兔抗人多克隆抗体141×103)购自北京博奥森生物技术有限公司;兔抗人α-tubulin单克隆抗体购自北京博奥森生物技术有限公司,辣根过氧化物酶标记山羊抗兔IgG抗体由北京博奥森生物技术有限公司进口分装;瑞士-吉姆萨复合染液购自珠海贝索生物技术有限公司;注射用阿糖胞苷(cytarabine,Ara-c)购自意大利Pharmacia公司,注射用盐酸柔红霉素(daunorubicin,DNR)购自意大利Pfizer公司。
1.2 细胞及细胞培养
K562/ADM细胞是人慢性髓细胞性白血病K562细胞的阿霉素耐药株,将K562/ADM细胞置于含10%胎牛血清(fetal bovine serum,FBS)、青霉素和链霉素各100 U/L的RPMI-1640培养基中,在37 ℃、CO2体积分数为5%的培养箱中悬浮培养,每2~3d传代1次。取生长状态良好、处于对数生长期的细胞进行实验。BGJ398粉剂用DMSO溶解为10 mmol/L母液备用。
1.3 CCK-8法检测细胞增殖抑制率
取100 L细胞悬液(2.5×103个细胞)接种到96孔板中,BGJ398的作用浓度分别为0.0、0.5、1.0、2.0、5.0、10.0、15.0 mol/L,每个浓度设3个复孔,在37 ℃、CO2体积分数为5%的培养箱中悬浮培养48 h后,每孔加入10 μL CCK-8增强型溶液,轻轻敲击培养板以混匀。培养箱内温育2 h,在450 nm波长下测定吸光度(D)值并计算细胞增殖抑制率。抑制率=[(Ac-As)/(Ac-Ab)]×100%。As:实验孔(含有细胞的培养基、CCK-8、待测药物)的D值;Ac:对照孔(含有细胞的培养基、CCK-8、没有待测药物)的D值;Ab:空白孔(不含细胞和待测药物的培养基、CCK-8)的D值。
1.4 细胞transwell迁移实验
将K562/ADM细胞分为3组:实验组、阴性对照组、空白对照组。实验组:加入FGFR抑制剂(10 μmol/L);阴性对照组:加入与实验组相同浓度的DMSO(1%);空白对照组:加入相同体积的细胞培养基。收集细胞,将3组K562细胞用无血清培养基重悬,取100 μL细胞悬液(3×104个/孔)种入上室,下室加完全培养基,每组设4个复孔,培养4 h后,除去transwell上室中的细胞,然后将下室中的细胞采用瑞士-吉姆萨复合染液进行染色,400倍光学显微镜下每组随机选取5个视野,计数穿膜的细胞个数,并计算每组的平均值。
1.5 流式细胞术检测细胞凋亡
取3组K562/ADM细胞,常规培养48 h后以2000 r/min离心5 min收集细胞,用磷酸盐缓冲液(phosphate-buffered saline,PBS)洗涤细胞2次,收集5×105个细胞,加入500 μL的Binding Buffer 悬浮细胞,加入5 μL Annexin Ⅴ-FITC混匀后,加入5 μL PI,混匀,室温、避光条件下,反应5~15 min,采用流式细胞术检测细胞凋亡情况。
1.6 CCK-8法检测化疗药物对各组细胞的半数抑制浓度(half maximal inhibitory concentration,IC50)
取对数生长期K562/ADM细胞,分为空白对照组、阴性对照组、实验组,每孔100 μL(含1×104个细胞)接种于96孔培养板上,每组细胞分别加入不同浓度的Ara-c、DNR,Ara-c终质量浓度为0、1、5、25、125、625 µg/mL,DNR终质量浓度为0、20、40、80、160、320 ng/mL,每个浓度设3个复孔,在37 ℃、CO2体积分数为5%的培养箱中悬浮培养48 h后,每孔加入10 μL CCK-8增强型溶液,轻轻敲击培养板以混匀。培养箱内温育2 h,在450 nm波长下测定D值并计算细胞增殖抑制率。调零后取各组平行孔平均值,计算细胞增殖抑制率。抑制率=(1-实验组A值/细胞对照组A值)×100%。
1.7 蛋白质印迹法(Western blot)检测MDR1(P-gp)蛋白的表达
取3组K562/ADM细胞,常规培养48 h后以2 000 r/min离心5 min收集细胞,用PBS洗涤细胞2次,依据蛋白提取试剂框说明书,依次加入Buffer A、B、C,充分裂解细胞膜和细胞核,取少量蛋白用BCA法测蛋白浓度,其余加5×十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecylsulphate polyacrylamide gel electrophoresis,SDS-PAGE)上样缓冲液煮沸5 min,-80 ℃保存备用。取等量标本进行SDS-PAGE,后将蛋白转移到PVDF膜上,用含5%脱脂奶粉的洗膜缓冲液(tris buffered saline Tween, TBST)封闭2 h,充分漂洗后加兔抗人多克隆抗体MDR1(稀释度为1∶400),4 ℃温育12 h,充分洗涤后加山羊抗兔二抗(稀释度为1∶2 000),室温温育1.5 h,漂洗后采用化学发光法显色。以α-tubulin作为内参重复进行以上步骤。采用Gel-Pro Analyzer软件分析结果,以MDR1/α-tubulin的比值作为目的蛋白的相对表达水平。
2 结果
2.1 BGJ398对K562/ADM细胞增殖的影响
统计显示,BGJ398的作用浓度分别为0.5、1.0、2.0 μmol/L时细胞的增殖抑制率与对照组差异无统计学意义(P>0.05),BGJ398的作用浓度分别为5.0、10.0、15.0 μmol/L时,细胞的增殖抑制率低于对照组,差异有统计学意义(F=144.1,P<0.001)。K562/ADM细胞增殖抑制率随药物浓度的增加而逐渐提高(图1),最小显著差别(least significant difference,LSD)组间两两比较发现,0.5和1.0 μmol/L组间差异无统计学意义(P=0.226),其余组间两两比较差异均有统计学意义(F=1 904.8,P<0.05)。以上结果提示BGJ398浓度高于5.0 μmol/L时能有效地抑制白血病细胞的增殖,后续实验采用10.0 μmol/L的作用浓度。
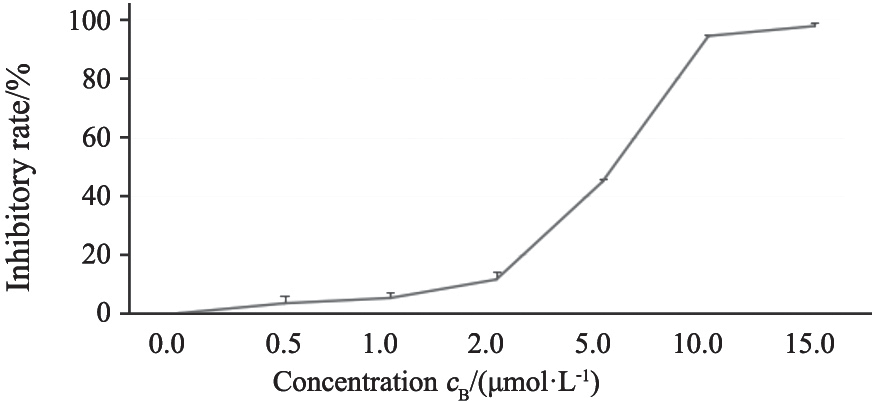
图 1 不同药物浓度组K562/ADM细胞增殖抑制率的比较
Fig. 1 Comparison of the inhibitory rate of K562/ADM cells in
different concentration groups
2.2 BGJ398对K562/ADM细胞迁移的影响
培养4 h后BGJ398组迁移的K562/ADM细胞数(11.00±3.00)较阴性对照组(57.67±14.57)和空白对照组(43.00±4.00)明显减少,差异有统计学意义( F =21.60,P=0.002),提示BGJ398可以有效抑制K562/ADM细胞迁移。
2.3 BGJ398对K562/ADM细胞凋亡的影响
实验组细胞凋亡率(81.49%±5.38%)显著增加,与空白对照组(10.09%±1.36%)和阴性对照组(7.64%±1.32%)相比,差异有统计学意义(F=487.28,P<0.001),FGFR抑制剂显著抑制耐药白血病细胞增殖,且促进其凋亡(图2)。
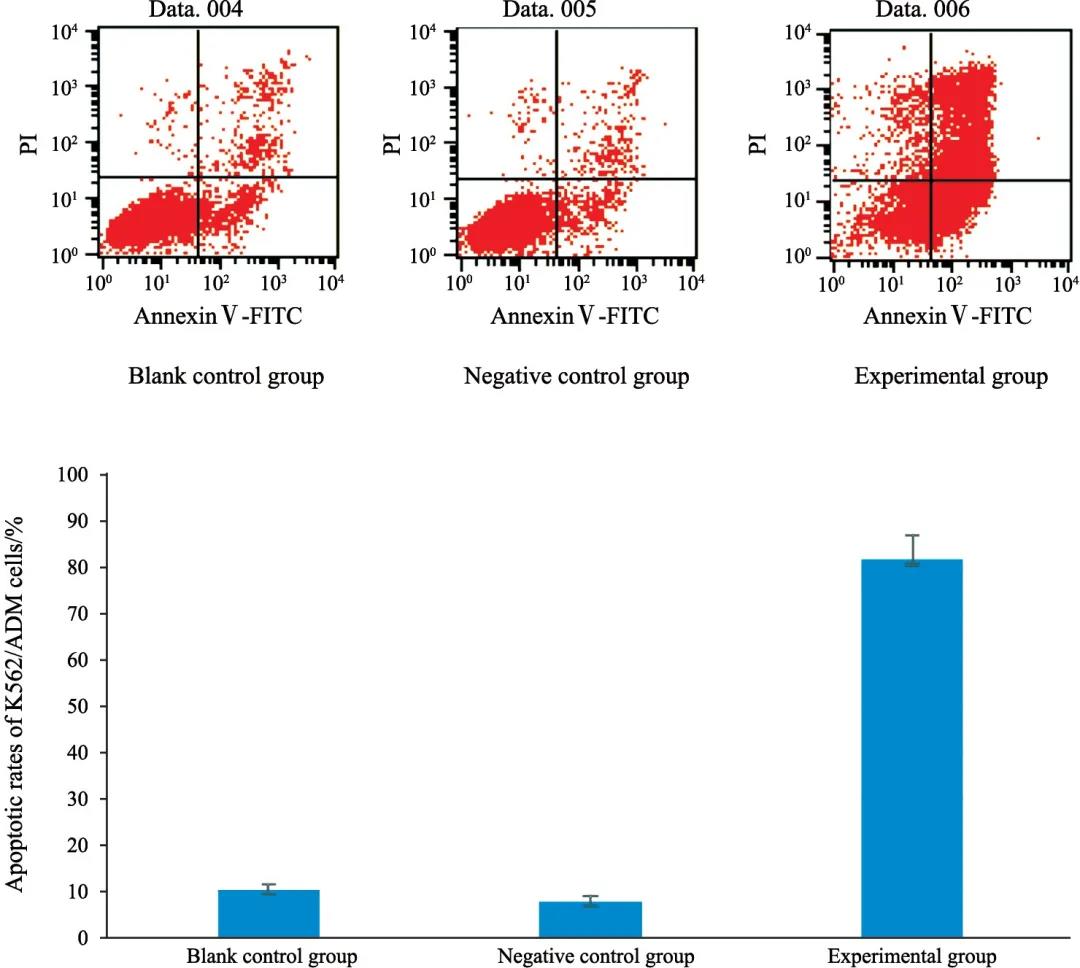
图 2 各组细胞凋亡率的比较
Fig. 2 Comparison of cell apoptotic rate in each group
2.4 FGFR抑制剂对化疗药物敏感性的影响
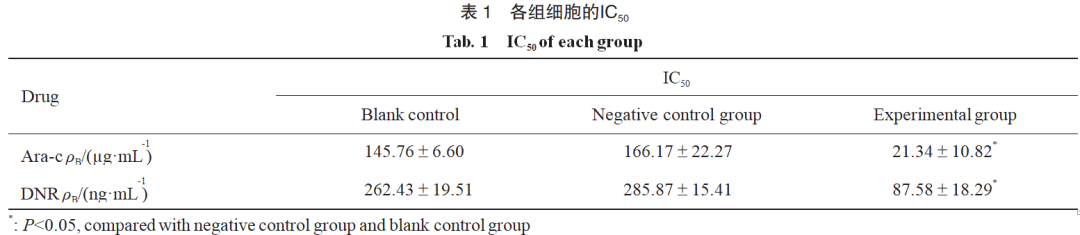
实验组细胞对Ara-c、DNR的IC50明显低于空白对照和阴性对照组细胞(Ara-c:F=55.39,P=0.000;DNR:F=110.94,P=0.000),空白对照组和阴性对照组相比差异无统计学意义(Ara-c:P=0.22;DNR:P=0.16),提示FGFR抑制剂能显著增强白血病细胞对Ara-c、DNR的药物敏感性,起到降低化疗药物浓度、增强疗效的作用(表1)。
2.5 FGFR抑制剂对MDR1(P-gp)蛋白表达水平的影响
Western blot实验结果显示,实验组MDR1蛋白表达水平为0.056 0±0.0088,空白对照组和阴性对照组MDR1蛋白表达水平分别为0.132 8±0.0122和0.1166±0.0188,实验组与空白对照组和阴性对照组相比差异有统计学意义(F=16.97,P<0.05),空白对照组和阴性对照组相比差异无统计学意义(P>0.05,图3)。
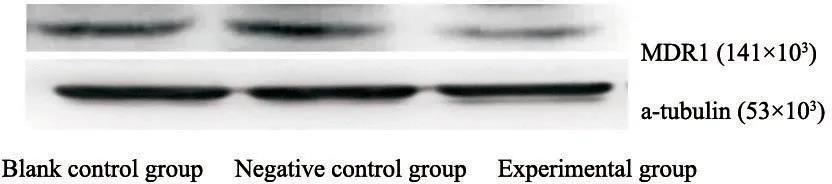
图 3 Western blot检测各组细胞MDR1(P-gp)蛋白表达水平
Fig. 3 The expression of MDR1(P-gp) protein was detected by Western blot
3 讨论
白血病是儿童最常见的恶性肿瘤,由于造血细胞恶性增殖可破坏骨髓正常功能、导致骨髓衰竭。慢性髓细胞性白血病仅占儿童和青少年白血病的2%~3%。儿童和青少年慢性粒细胞白血病往往表现出更具侵袭性的特征[7]。因此,儿童慢性髓细胞性白血病需要更加有效的治疗措施。
FGFR信号通路参与细胞生长、分化和迁移,因此FGFR扩增、突变或基因融合导致的信号通路异常激活与多种癌症的发病机制有关,例如尿路上皮癌中的FGFR3突变[8]。白血病微环境的保护作用可导致白血病细胞持续存活、耐药和复发。Javidi-Sharifi等[9]研究发现,骨髓基质细胞的FGF2在外泌体中分泌,这些外泌体随后被白血病细胞内吞,并保护白血病细胞免受酪氨酸激酶抑制剂的伤害,FGF2及其受体FGFR1在基质细胞亚群和急性髓细胞性白血病基质中的表达均增加,FGF2-FGFR1信号通路的增加与外泌体分泌的增加有关,FGFR抑制剂阻断基质自分泌生长,显著降低含FGF2的外泌体的分泌,导致白血病细胞的基质保护作用减弱;因此,抑制FGFR的作用可以调节骨髓基质功能,减少外泌体分泌,降低耐药性,改善疗效。
尼达尼布是一种三重血管激酶抑制剂,可抑制血管内皮生长因子受体(vascular endothelial growth factor receptor,VEGFR)、血小板衍生生长因子受体(platelet-derived growth factor receptor,PDGFR)。有研究[10]将尼达尼布与小剂量Ara-c联合应用于治疗老年急性髓细胞性白血病患者,结果显示,该药物的安全性和治疗效果较好,为难治性白血病患者带来了新的希望,但尚无应用于儿童白血病的报道。尼达尼布是多靶点抑制剂,其使用受到不良反应的限制,易引起心血管和肝脏毒性[11]。
BGJ398是成纤维细胞生长因子受体抑制剂,能有效地抑制FGFR1、FGFR2和FGFR3,但对FGFR4的抑制作用较弱。Ma等[12]研究发现,BGJ398能有效地抑制人脂肪干细胞的增殖。本研究发现,BGJ398能显著抑制耐药细胞株K562/ADM的增殖,BGJ398浓度大于5.0 μmol/L时对肿瘤细胞抑制作用比较明显,浓度继续增大,浓度为15.0 μmol/L时抑制率达到97.41%,浓度≥15.0 μmol/L时不良反应可能会大大增加,因此药物浓度在10.0 μmol/L左右比较合适,既保证疗效又可减少药物引起的不良反应。BGJ398作用浓度为10.0 μmol/L时能有效地抑制耐药细胞株的迁移,对白血病细胞的肝、脾、淋巴结、骨骼浸润起到很好的抑制作用。BGJ398具有显著促进耐药白血病细胞株凋亡的作用,BGJ398与常规化疗药物Ara-c、DNR联合应用可起到增强疗效、降低不良反应的效果。进一步通过机制研究发现,FGFR抑制剂能显著降低耐药蛋白MDR1的表达水平,提示MDR1可能是BGJ398逆转K562/ADM耐药的作用靶点之一。
BGJ398的作用还存在不足之处。BGJ398自身在治疗肿瘤性疾病过程中也会产生耐药性,如BGJ398治疗胆管癌的Ⅱ期临床试验[13]表明,随着用药时间延长,机体也会对BGJ398产生耐药性,需要应用mTOR抑制剂克服耐药。目前有研究[14]发现,TAS-120是一种新型的不可逆FGFR抑制剂,对BGJ398耐药胆管癌有更好的治疗效果。
综上,FGFR抑制剂能显著抑制白血病细胞增殖和迁移,促进其凋亡,增强化疗药物的敏感性并降低耐药蛋白的表达水平,可能成为逆转白血病耐药的新靶点。FGFR抑制剂已成为目前抗肿瘤治疗的研究热点之一,新型FGFR抑制剂不断涌现,为人类克服肿瘤性疾病带来了新希望。
[参考文献]
BEENKEN A, MOHAMMADI M. The FGF family: biology, pathophysiology and therapy[J]. Nat Rev Drug Discov, 2009, 8(3): 235-253. SIEBERT H C, LU S Y, WECHSELBERGER R, et al. A lectin from the Chinese bird-hunting spider binds sialic acids[J]. Carbohydr Res, 2009, 344(12): 1515-1525. DEMOULIN J B, MEDVES S, TOFFALINI F, et al. Role of PDGF and FGF receptors in cancer[J]. Bull Mem Acad R Med Belg, 2010, 165(5-6): 310-315. KNIGHTS V, COOK S J. De-regulated FGF receptors as therapeutic targets in cancer[J]. Pharmacol Ther, 2010, 125(1): 105-117. IVAN M, MATEI D. Blockade of FGF signaling: therapeutic promise for ovarian cancer[J]. Cancer Biol Ther, 2010, 10(5): 505-508. BOURRIÉ B, BRASSARD D L, COSNIER-PUCHEU S, et al. SAR103168: a tyrosine kinase inhibitor with therapeutic potential in myeloid leukemias[J]. Leuk Lymphoma, 2013, 54(7): 1488-1499. HIJIYA N, SCHULTZ K R, METZLER M, et al. Pediatric chronic myeloid leukemia is a unique disease that requires a different approach[J]. Blood, 2016, 127(4): 392-399. HELSTEN T, ELKIN S, ARTHUR E, et al. The FGFR landscape in cancer: analysis of 4 853 tumors by next-generation sequencing[J]. Clin Cancer Res, 2016, 22(1): 259-267. JAVIDI-SHARIFI N, MARTINEZ J, ENGLISH I, et al. FGF2-FGFR1 signaling regulates release of leukemia-protective exosomes from bone marrow stromal cells[J]. Elife, 2019, 8: e40033. SCHLIEMANN C, GERSS J, WIEBE S, et al. A phase Ⅰ dose escalation study of the triple angiokinase inhibitor nintedanib combined with low-dose cytarabine in elderly patients with acute myeloid leukemia[J]. PLoS One, 2016, 11(10): e0164499. TOUAT M, ILEANA E, POSTEL-VINAY S, et al. Targeting FGFR signaling in cancer[J]. Clin Cancer Res, 2015, 21(12): 2684-2694. MA Y, KAKUDO N, MORIMOTO N, et al. Fibroblast growth factor-2 stimulates proliferation of human adipose-derived stem cells via Src activation[J]. Stem Cell Res Ther, 2019, 10(1): 350. KROOK M A, LENYO A, WILBERDING M, et al. Efficacy of FGFR inhibitors and combination therapies for acquired resistance in FGFR2-fusion cholangiocarcinoma[J]. Mol Cancer Ther, 2020, 19(3): 847-857. GOYAL L, SHI L, LIU L Y, et al. TAS-120 overcomes resistance to ATP-competitive FGFR inhibitors in patients with FGFR2 fusion-positive intrahepatic cholangiocarcinoma[J]. Cancer Discov, 2019, 9(8): 1064-1079.
作者: 张艳君,李建厂,贾秀红,等. FGFR抑制剂BGJ398对白血病细胞生物学行为及耐药的影响[J]. 中国癌症杂志, 2021, 31(3): 176-181.
